Ⅰ.
Généralité
☰ Le Staphylococcus
a développé
différents types de résistance aux anti-staphylococciques:
- Plus de 95 % des souches produisent une pénicillinase ( l’oxacilline reste active contre
ces
souches ).
- Des staphylocoques hospitaliers et plus récemment communautaires ont développé une
résistance
croisée entre
l’oxacilline et les autres bêtalactamines par production d’une protéine liant les
pénicillines
(PLP) de faible affinité, la
PLP2a.
- Trois enzymes sont responsables de l’inactivation des aminosides, chacune conférant un
spectre
spécifique de
résistance.
- Les glycopeptides, vancomycine et
teicoplanine, sont des
alternatives à l’oxacilline en cas de
résistance ou
d’intolérance. Des souches de sensibilité diminuée aux glycopeptides sont
rapportées (Leur
détection est difficile).
- La résistance aux macrolides est surtout
liée à la production de
méthylase qui
modifie le
ribosome, cible de ces
antibiotiques.
- La résistance aux quinolones
est liée à des mutations de la cible de
ces
antibiotiques, les
topo-isomérases.
- De nouveaux anti-staphylococciques ont été récemment commercialisés, le , la
daptomycine et la
tigécycline. Des résistances, encore rares, sont déjà rapportées.
Des
anti-staphylococciques existent dans toutes les familles d’antibiotiques
( hormis les
polymyxines et les
imidazolés ). Les anti-staphylococciques les plus utilisés appartiennent aux familles suivantes :
les bêtalactamines
( l’oxacilline du groupe des pénicillines M ),
les glycopeptides
( vancomycine ou teicoplanine ) en cas de résistance ou
d’intolérance à cette première classe,
les aminosides
( gentamicine ), qui permettent d’obtenir une bactéricidie rapide
en association à l’une des deux classes précédentes, et les fluoroquinolones.
D’autres antibiotiques sont également utilisés : les streptogramines (pristinamycine), les
macrolides, la clindamycine,
le cotrimoxazole, la rifampicine, l’acide fusidique et la fosfomycine. Ces trois dernières
molécules sont données en
association du fait des fréquences élevées de mutations.
Ⅱ. Détection de
la résistance
aux
bêtalactamines
❶ Résistance à la pénicilline par production de
pénicillinase
- Se sont des pénicillinases à spectre étroit groupe fonctionnel 2a, plasmidique,codés par
le gène
blaZ ,
inductible ( méticilline, oxacilline, CTX )
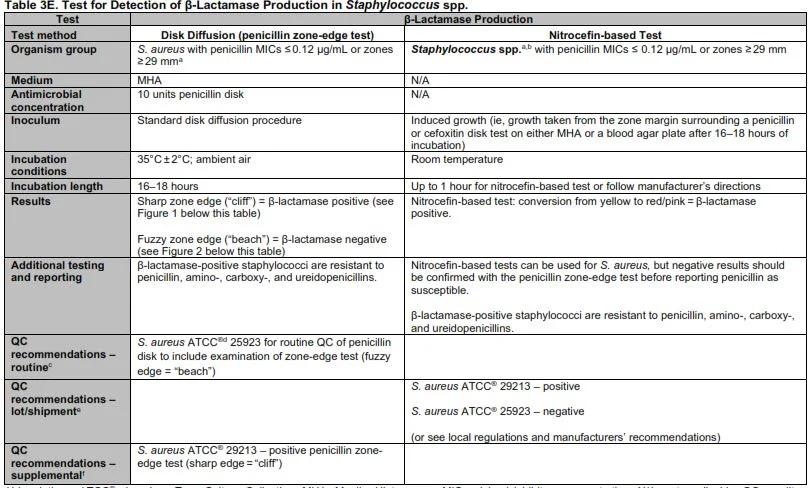
❶-A- détection de la pénicillinase selon CA-SFM 2020
☰ La méthode de diffusion en milieu gélosé est plus fiable que la détermination de la CMI pour
la détection de souche
productrice de pénicillinase, car elle visualise le diamètre d'inhibition ET l'aspect de la
bordure.
- » Si le diamètre est <26 mm la souche est résistante .
- » Si le diamètre est ≥26 mm ET la bordure nette, la souche est
résistante.
- » Si le diamètre est ≥26 mm ET la bordure est floue, la souche est
sensible.
Interprétation : Les souches productrices de pénicillinase
(Mais sensibles à
la céfoxitine) sont résistantes à la
pénicilline G, à la phénoxyméthylpénicilline, aux aminopénicillines, aux carboxypénicilines et aux
ureidopénicillines
et sensibles à l’association pénicilline – inhibiteur de bêta-lactamase et aux pénicillines
résistantes aux pénicillinases
(oxacilline, cloxacilline, dicloxacilline et flucloxacilline), aux céphalosporines (sauf à la
ceftazidime, ceftazidime-
avibactam, cefixime, ceftibuten et ceftolozane-tazobactam qui ne doivent pas être utilisés pour le
traitement des
infections staphylococciques) et aux carbapénèmes.
Commentaire :
- Il n’existe pas de méthode fiable de détection de la production de pénicillinase pour les espèces
autres que S.
aureus. La sensibilité à la pénicilline ne doit pas être rendue pour les stapylocoques non-aureus.
- Le test chromogénique de détection de pénicillinase manque de sensibilité pour détecter de façon
fiable la
production de pénicillinase par les staphylocoques.
❶-B- détection de la pénicillinase selon CLSI 2020
☰ La pénicilline doit être utilisée pour tester la sensibilité de tous les staphylocoques :
- » Si le diamètre est ≥ 29 mm ou la CMI ≤ 0.12 µg/mL la souche est sensible .
- » Si le diamètre est ≤ 28 mm ou la CMI ≥ 0.25 µg/mL la souche est résistante .
Interprétation : Selon le CLSI les pénicillines sont séparées en 2
catégories :
les agents labiles à la pénicillinase et
les agents stables à
la
pénicillinase selon le
tableau suivant :
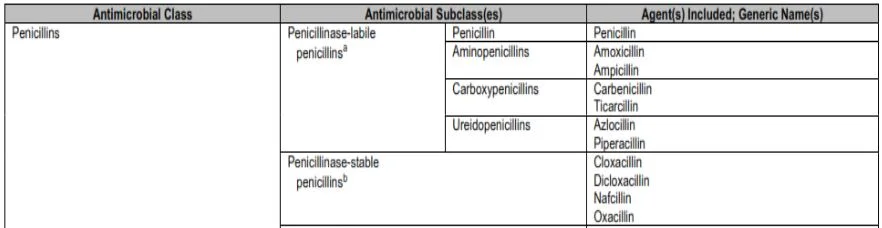
- Les staphylocoques sensibles à la pénicilline sont sensibles aux autres β-lactamines dont
l'efficacité clinique
est établie (y compris les agents labiles à la pénicillinase et les agents stables à la
pénicillinase).
- Les staphylocoques résistants à la pénicilline sont résistants aux pénicillines labiles à la
pénicillinase.
☰ De rares isolats de staphylocoques portant des gènes codant pour la production de
β-lactamase peuvent apparaître
négatifs aux tests de β-lactamase. Par conséquent, pour les infections graves nécessitant un
traitement à la
pénicilline, les laboratoires doivent effectuer des tests CMI et des tests de β-lactamase sur tous
les isolats ultérieurs
du même patient. Le test PCR de l'isolat pour le gène de la β-lactamase blaZ peut être envisagé.
☰ Certains isolats de staphylocoques producteurs de β-lactamases sont sensibles à la
pénicilline. La β-lactamase
staphylococcique étant facilement inductible, il existe un risque que cela se produise si la
pénicilline était utilisée
pour traiter ces souches. Pour cette raison, il est recommandé que les isolats de Staphylococcus
avec des CMI de
pénicilline ≤ 0,12 µg / mL ou des diamètres de zone ≥ 29 mm soient testés pour la production de
β-lactamase avant
de déclarer l'isolat comme sensible à la pénicilline
Commentaire :
Les tests de routine des isolats urinaires de Staphylococcus saprophyticus ne sont pas recommandés,
car les
infections répondent aux concentrations obtenues dans l'urine d'agents antimicrobiens couramment
utilisés pour
traiter les infections urinaires aiguës non compliquées (eg, nitrofurantoin, trimethoprim ±
sulfamethoxazole, or a
fluoroquinolone).
BORSA (Borderline Oxacillin Resistant S. aureus) : ces souches montrent une
activité diminuée de l'oxacilline (ou
une résistance de bas niveau) non due à la présence du gène mecA mais à l'hyperproduction de
pénicillinase
touchant l’oxacilline. Elles ont une CMI de l'oxacilline égale à 2mg/L (sensible mais limite).
❷ Résistance à la pénicilline par Modification de la
cible
☰ Historiquement, la résistance aux pénicillines stables à la pénicillinase était appelée «
résistance à la
méticilline » ou « résistance à l’oxacilline ». Les
MRSA sont des souches de S. aureus
qui expriment mecA,
mecC ou un autre mécanisme de résistance à la méticilline (oxacilline), comme les changements
d'affinité
des protéines de liaison à la pénicilline pour l'oxacilline (souches modifiées de S. aureus).
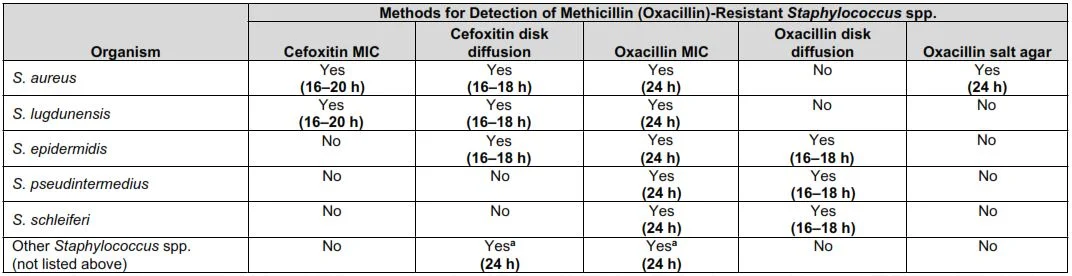
❷-A- détection de la Méticillino-résistance selon CA-SFM 2020
☰ La résistance des staphylocoques aux isoxazolyl-pénicillines (oxacilline,
cloxacilline) est
recherchée à l’aide d’un
disque de céfoxitine (30 μg) dans les conditions standard de l’antibiogramme (il ne
doit pas être
tenu compte d’une
éventuelle zone fantôme pour la lecture des diamètres d’inhibition) :
Pour les S. aureus, et S. non-aureus autres que S. epidermidis :
- » Si le diamètre de FOX est < 22 mm la souche est résistante.
-
» Si le
diamètre de FOX est ≥ 22 mm la souche est sensible.
Pour les S. epidermidis :
- » Si le diamètre de FOX est < 25 mm la souche est résistante.
-
» Si le
diamètre de FOX est ≥ 25 mm la souche est sensible.
Interprétation : Les souches de staphylocoques résistantes à la
céfoxitine
ou possédant un gène mec additionnel
(mecA, mecC) ou exprimant une PLP2 additionnelle (PLP2a) après
induction par une
bêta-lactamine,
doivent être
interprétées résistantes à toutes les bêta-lactamines (pénicillines associées ou
non à un inhibiteur
de bêta-
lactamase, céphalosporines et carbapénèmes), sauf à la ceftaroline et au ceftobiprole (possèdent une
activité sur les
staphylocoques résistants à l’oxacilline mais leur activité doit être testée séparément).
Pour S. Saprophyticus :
- » Si le diamètre autour du disque de l’AMP est ≥ 18 mm, la souche est mecA-negative et
sensible à
l’ampicilline, l’amoxicilline et la piperacilline (avec ou sans inhibiteur de bêta-lactamase).
- » Si le diamètre autour du disque de l’AMP est < 18 mm, la souche est résistante à
l’ampicilline, l’amoxicilline et la piperacilline et il faut réaliser un test cefoxitine
pour déterminer la sensibilité à la méticilline.
❷-B-
Détection
de la Méticillino-résistance selon CLSI 2020
☰ La détection de la résistance à la méthicilline (oxacilline)
chez les
staphylocoques est obtenue à l'aide de méthodes
énumérées dans le tableau suivant :
Pour les S. aureus et S. lugdunensis :
- » Si le diamètre de FOX est < 22 mm ou CMI ≥ 8 µg/mL la souche est
résistante.
- » Si la CMI OXA ≥ 4 µg/mL la souche est résistante.
- » Si le diamètre de FOX est ≥22 mm ou CMI ≤ 4 µg/mL la souche est sensible.
- » Si la CMI OXA ≤ 2 µg/mL la souche est sensible.
Pour les S. epidermidis :
- » Si le diamètre de FOX est < 24 mm la souche est résistante.
- » Si le diamètre de OXA est < 18 mm ou CMI ≥ 0.5 µg/mL la souche est
résistante.
- » Si le diamètre de FOX est ≥ 25mm sensible.
- » Si le diamètre de OXA est ≥18 mm ou CMI ≤ 0.25 µg/mL la souche est sensible.
Pour les S.pseudintermedius et S. schleiferi:
- » Si le diamètre de OXA est < 18 mm ou CMI ≥ 0.5 µg/mL la souche est
résistante.
- » Si le diamètre de OXA est ≥18 mm ou CMI ≤ 0.25 µg/mL la souche est sensible.
Pour les autres staphylococcus spp :
- » Si le diamètre de FOX est < 24 mm la souche est résistante.
- » Si le CMI de OXA est ≥ 0.5 µg/mL la souche est résistante.
- » Si le diamètre de FOX est ≥ 25mm sensible.
- » Si le CMI de OXA est ≤ 0.25 µg/mL la souche est résistante.
Interprétation : Les staphylocoques résistants à la méthicilline
(oxacilline) sont résistants à tous les bêta-lactamines
actuellement disponibles, à l'exception de la ceftaroline.
Commentaire :
Les mécanismes de résistance à la méthicilline (oxacilline) autres que
mecA sont rares et
comprennent un nouvel homologue mecA, mecC. Les CMI pour les souches avec mecC sont
généralement
résistantes à la céfoxitine et sensibles à l’oxacilline ; La résistance mecC ne peut pas
être détectée par des tests
dirigés vers mecA ou Plp2a.
MODSA (Modified S. aureus) ou résistance par modification des PLP : la
modification des PLP normalement
présentes chez S. aureus (surtout la PLP4) entraine des CMI « borderline » ou limites de
l'oxacilline. Les recherches
de la PLP2a ou du gène mecA sont négatives. Pour confirmer une souche MODSA, réaliser un
antibiogramme avec un
disque d'imipenème (PLP1), de céfotaxime (PLP2), d'oxacilline (PLP3) et de
céfoxitine (PLP4). Des discordances entre
les differents disques sont observees : la souche etant resistants aux uns et pas aux
autres
Ⅲ-
Détection
de la
résistance aux Aminosides
☰ La résistance acquise des staphylocoques aux aminosides est
surtout due à la
production d’enzymes inactivatrices.
Les enzymes sont divisées en trois classes selon la réaction catalysée : Aminoside
N-acétyltransférase (AAC),
Aminoside O-phosphotransférase (APH), Aminoside nucléotidyl-transférase (ANT)
☰ En pratique, il suffit de tester les aminosides qui sont les meilleurs substrats
pour les enzymes inactivatrices, la
kanamycine, la tobramycine et la gentamicine. Il n’est pas utile de tester l’amikacine
et la nétilmicine qui risquent
d’induire des réponses faussement sensibles ( REVUE FRANCOPHONE DES LABORATOIRES )
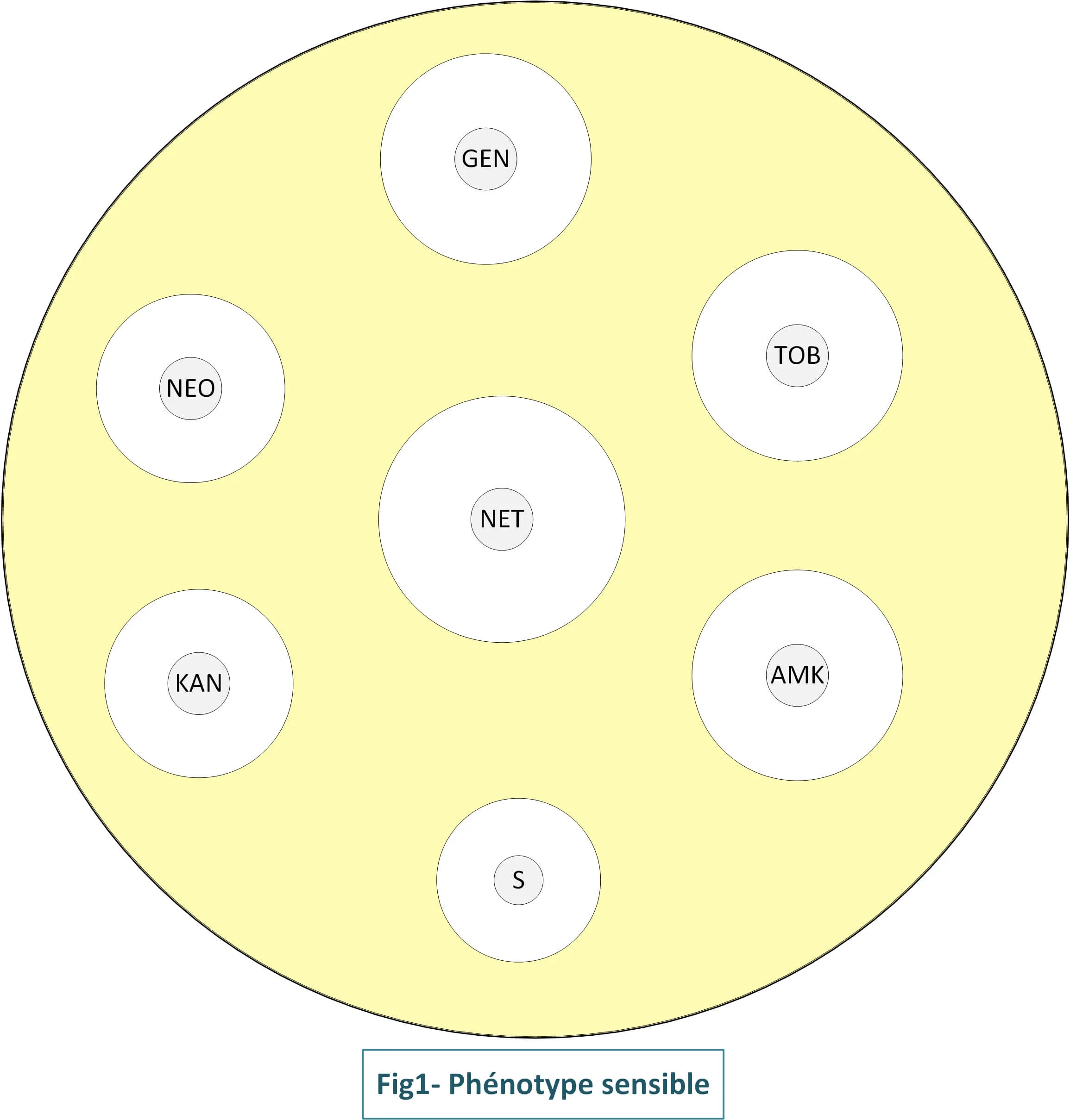
☰ Cinq phénotypes peuvent être distingués :
1- Phénotype sensible
S. aureus et les staphylocoques à coagulase négative sont normalement
sensibles aux aminosides (Fig.1). Les staphylocoques à coagulase négative
sont plus sensibles que S. aureus.
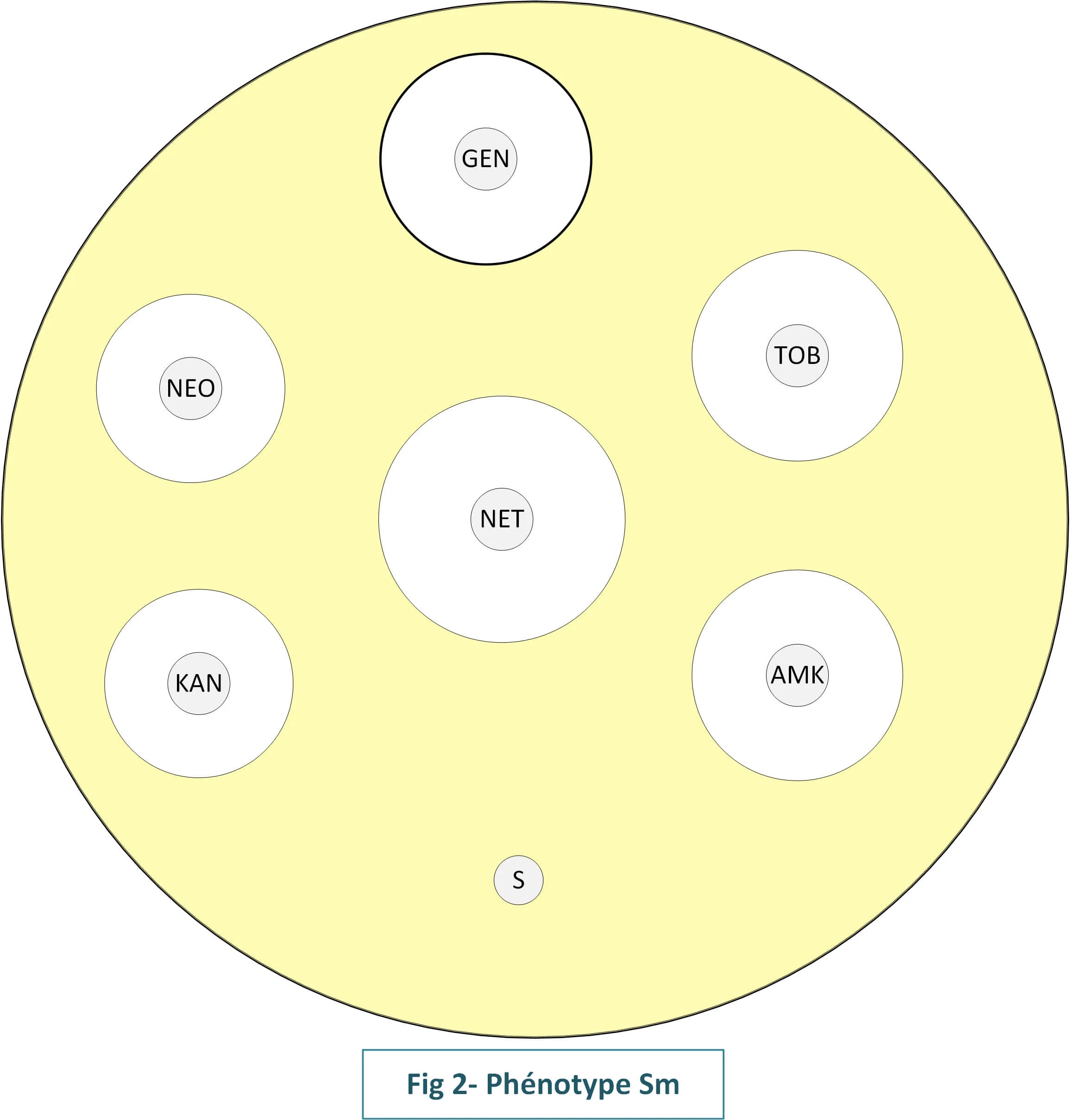
2- Phénotype Sm[ANT(6)]
Ce phénotype de résistance de haut niveau isolée à la streptomycine (Fig2)
est dû soit à la présence d'une ANT(6) soit à une mutation ribosomale.
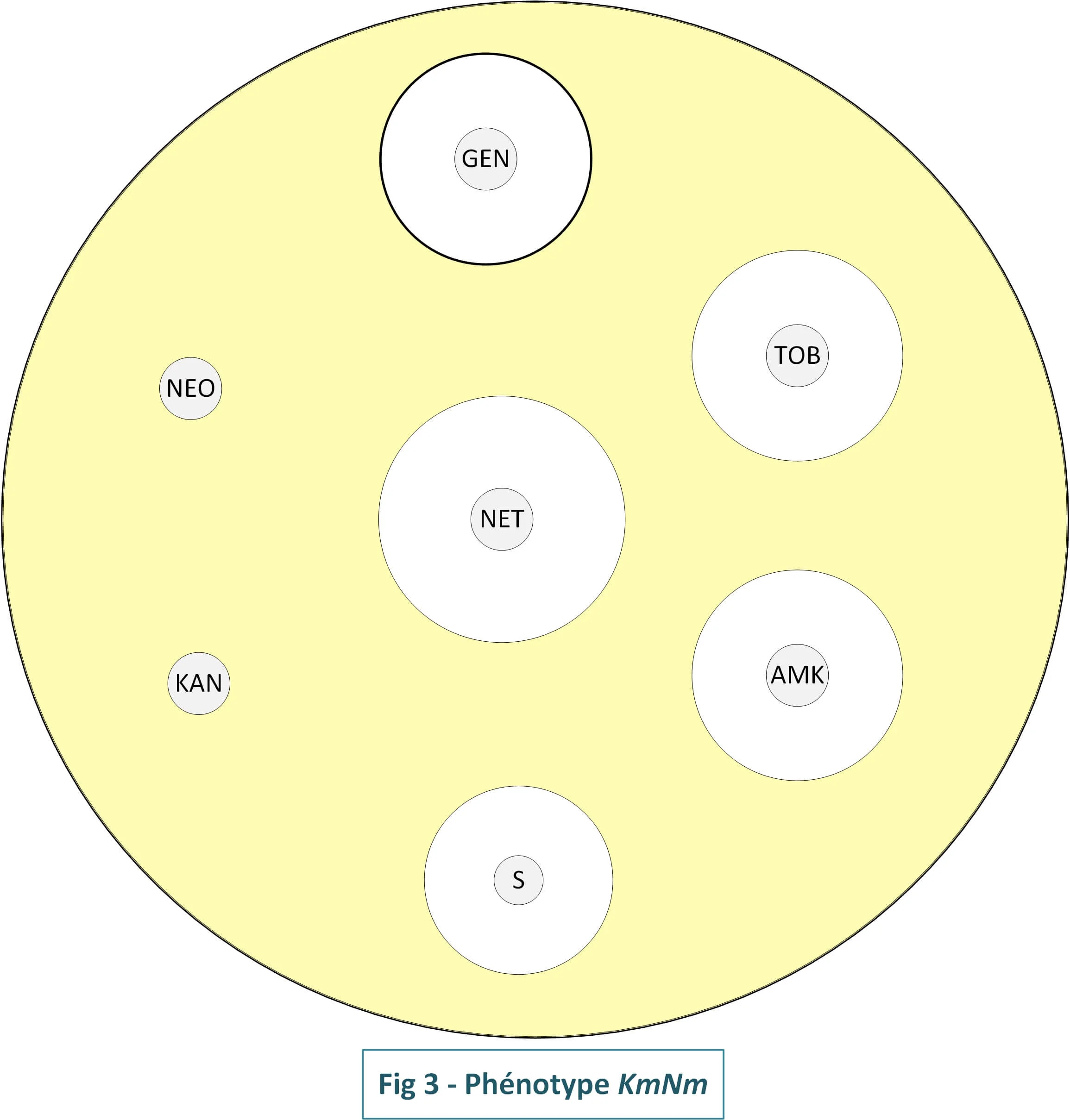
3- Phénotype KmNm[APH(3')]
Ce phénotype consiste en la résistance de haut niveau à la kanamycine et à
la néomycine (Fig3). Il est dû
la présence d'une APH(3')-III qui modifie ces deux antibiotiques mais aussi
amikacine et l'isépamicine
Interprétation : l'amikacine prend la
même interprétation de la kanamycine :
kanamycine = R → → Amikacine = R
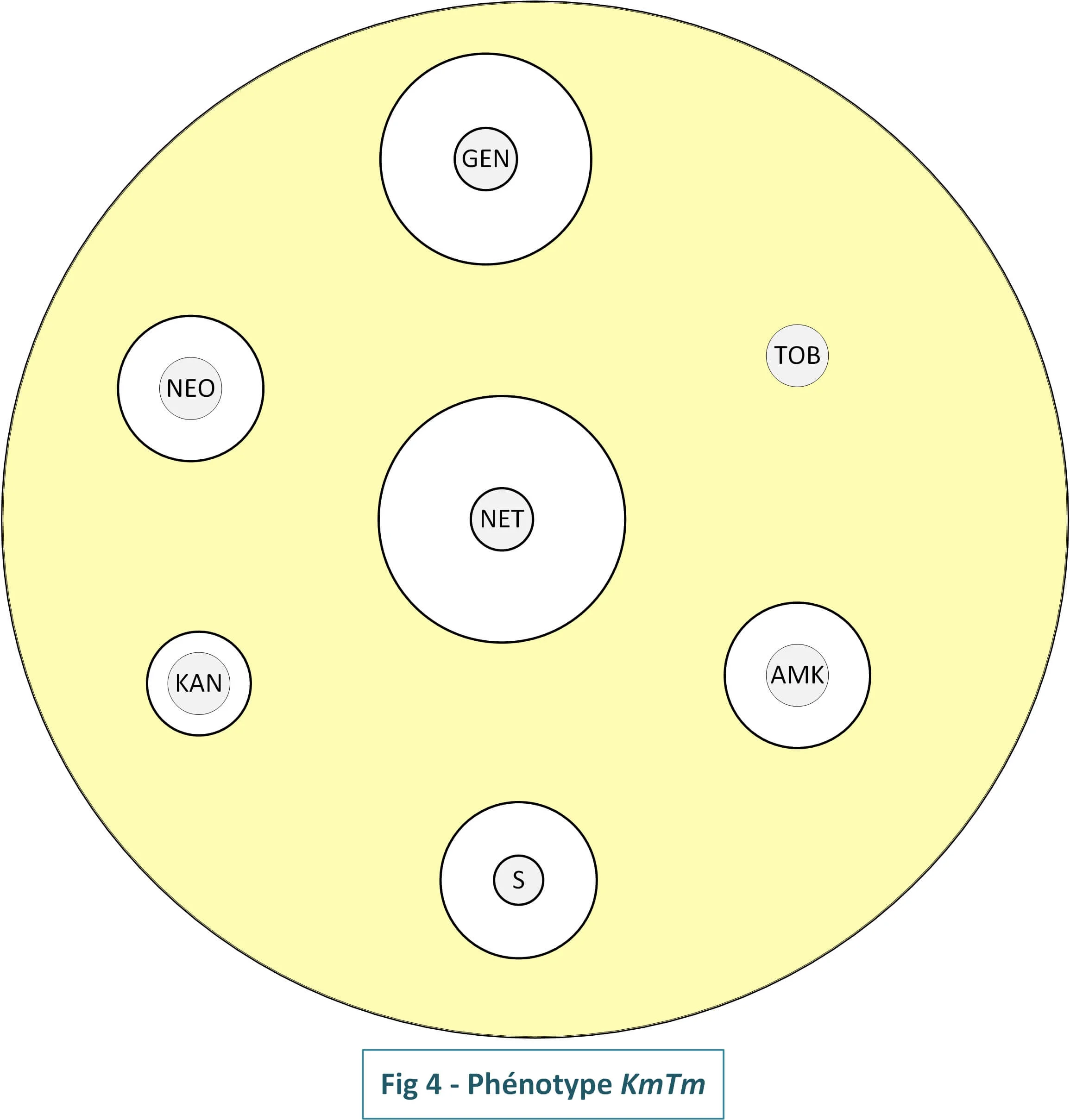
4- Phénotype KmTm[ANT(4')]
Ce phénotype consiste en la résistance de haut niveau à la kanamycine et
surtout à la tobramycine (Fig4). Il est dû
la présence d'une ANT(4') qui modifie ces deux antibiotiques mais aussi
partielement amikacine et l'isépamicine
Interprétation : l'amikacine et
kanamycine prennent la même interprétation de la tobramycine :
tobramycine = R → → Amikacine = R et Kanamycine= R
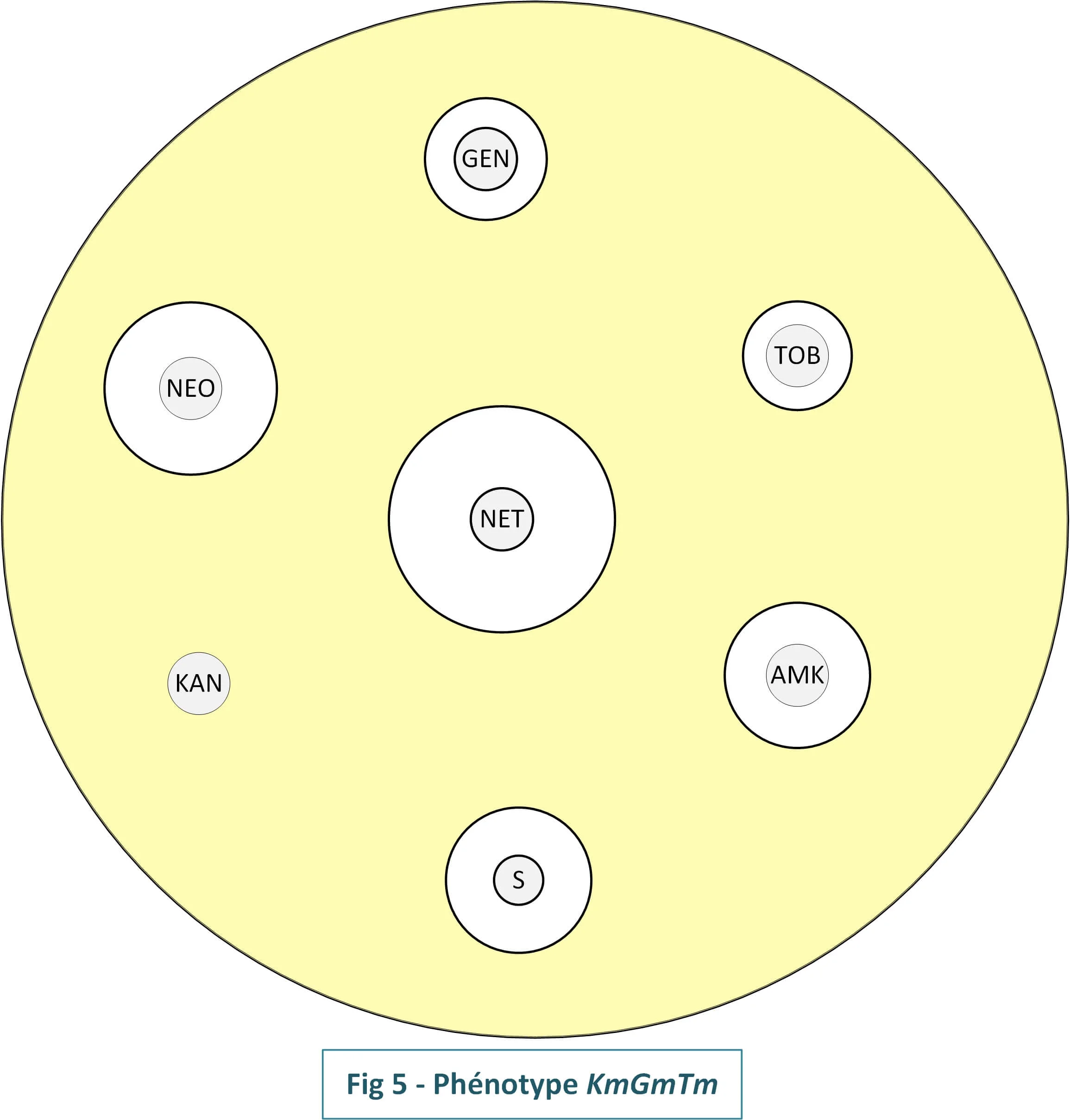
5- Phénotype KmGmTm[AAC(6)-APH(2")]
Ce phénotype consiste en la résistance de haut niveau à la kanamycine, la
gentamicine et à la tobramycine (Fig4). Il est dû
la présence d'une AAC(6)-APH(2"),La néomycine n'est pas touchée par cette
enzyme (modifié partielement amikacine et la nétilmicine
Interprétation :
-
L'interprétation de la gentamicine est valable pour nétilmicine.
- Les
souches résistantes à la gentamicine sont résistantes à l'ensemble des
aminosides .