Contenu :
◉ Définition
La coloration de Gram est la coloration différentielle microbiologique la plus importante et la plus largement utilisée, publiée par Hans Christian Gram en 1884, elle permet de différencier les bactéries selon 2 critères principaux : leur forme et leur affinité pour les colorants :
- Forme : Paires, Tétrades, Groupes, Chaînes, Lancettes...
- Affinité pour les colorants : Gram positif ou Gram négatif
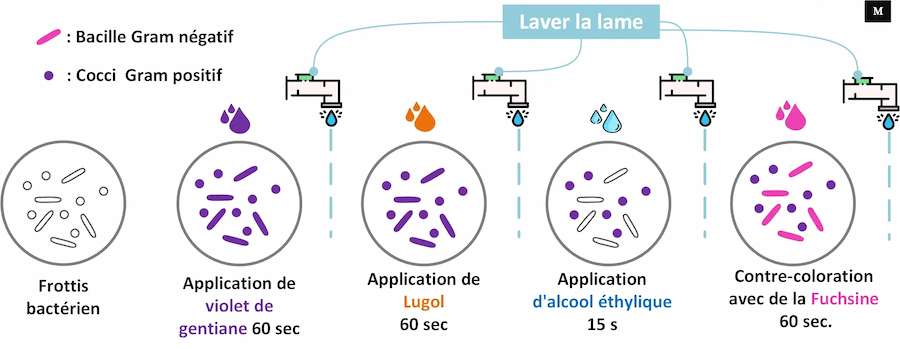
◉ Principe de la coloration de Gram
Qu'est-ce qui fait que certaines bactéries retiennent le violet gentiane (Gram positif) tandis que d'autres libèrent facilement le colorant lorsqu'on ajoute de l'alcool (Gram négatif) ?
- Les parois des bactéries à Gram négatif ont un taux élevé de lipides (à cause de la membrane externe) et une fine couche de peptidoglycane. L'alcool contenu dans le décolorant extrait le lipide, ce qui rend la paroi des bactéries à Gram négatif plus poreuse, et incapable de retenir le complexe violet-lugol, décolorant ainsi la bactérie.
- Le peptidoglycane plus épais et le degré de réticulation plus élevé piège le complexe violet-lugol plus efficacement, ce qui rend la paroi Gram positif moins sensible à la décoloration.
De plus, la coloration Gram-positive et Gram-négative des bactéries révèle la morphologie globale des bactéries, de sorte que les bactéries peuvent également être étiquetées en tant que bacilles ou cocci.
◉ Composition et préparation des colorants
Globalement :
- Violet de gentiane phéniqué :
• violet de gentiane : ..........10 g
• phénol : ......................20 g
• éthanol (95 °GL) :.......... 100 ml
• eau distillée : ...............01 l
- Solution iodée de Gram ou lugol : iodure de potassium : 20 g ; iode métalloïde I2 : 10 g ; eau 1 l ;
- Solution de safranine : safranine O :25 g ; éthanol à 95 °GL : 100 ml ; solution aqueuse d'oxalate d'ammonium à 25 g/l : 800 ml ;
- ou fuchsine pour Gram : fuchsine de Ziehl = fuchsine basique : 10 g ; phénol : 50 g ; éthanol : 100 ml ; eau distillée : 1 l. Diluer au 1/10° pour la fuchsine pour GRAM ;
- Décolorant alcool acétone : éthanol (alcool) "absolu" 5 volumes ; acétone : 1 volume ;
Conservation :
- En flacon hermétique, à l'abri de la lumière, de préférence au frais : plus de 3 ans sauf pour la fuchsine diluée.
- Attention : filtrer lorsque l'on rempli les flacons pour l'utilisation quotidienne à partir des flacon de réserve.
◉ Les étapes de la coloration de Gram
• Quelle que soit le colorant utilisé la technique reste sensiblement la même comme suite:
❶ Inonder le frottis séché à l'air et fixé à la chaleur pendant 1 minute avec le réactif de coloration au cristal violet. Veuillez noter que la qualité du frottis (concentration cellulaire trop lourde ou trop légère) affectera les résultats de la coloration.
❷ Laver la lame dans un jet doux et indirect d'eau du robinet pendant 2 secondes
❸ Inondation avec le mordant : iode ou lugol. Attendez 1 minute
❹ Laver la lame dans un jet doux et indirect d'eau du robinet pendant 2 secondes.
❺ Inondation la lame avec agent décolorant. Attendre 15 secondes ou ajouter goutte à goutte pour faire sortir l'agent de décoloration
❻ Inondation la lame avec contre-colorant,'safranine'. Patienter 30 secondes à 1 minute.
❼ Laver la lame dans un jet d'eau douce et indirecte de l'eau du robinet jusqu'à ce qu'aucune couleur n'apparaisse dans l'effluent, puis sécher avec du papier absorbant.
❽ Observez les résultats de la procédure de coloration sous immersion dans l'huile.Examiner au microscope, objectif x100
À la fin , les bactéries à GRAM négatif tacheront le rose / rouge et les bactéries à Gram positif tacheront le bleu / violet.
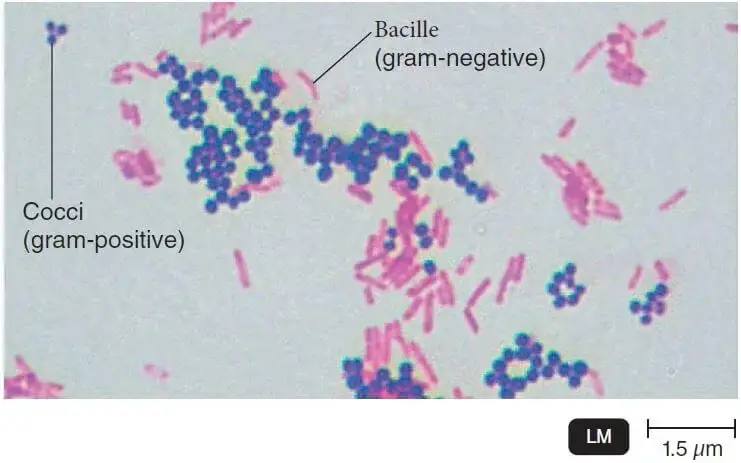
- Il faut cependant savoir que la coloration de Gram peut être variable pour une même espèce (par exemple, le pneumocoque se décolore facilement, de même, certaines bactéries Gram positif quand les colonies sont âgées).
- Certaines bactéries sont même dites « Gram faible » ou « Gram variable » (ex: corynébactéries).
☰ Risques d'erreurs
- Attention, une mauvaise coloration peut conduire à des erreurs d'identification bactérienne ou à une mauvaise orientation de diagnostic.
Faux positif
- étalement trop épais (mauvaise décoloration des bactéries en profondeur),
- dépôt de colorant dans le flacon de violet de gentiane : filtrer le colorant pour y remédier
- solution iodée mal égouttée,
- décolorant laissé trop peu de temps,
- utilisation de la fuchsine avec certains germes : les Neisseria et les Acinetobacter , en particulier, sont "avides" en fuchsine et la concentrent jusqu'à un rouge sombre difficile à distinguer du violet.
Faux négatif
- dans toute population de Gram + on voit des Gram - (parfois très nombreux) : ce sont des cadavres de bactéries Gram +,
- colorants de mauvaise qualité ou trop dilués,
- solution de lugol laissée trop peu de temps,
- décolorant laissé trop longtemps ou mal rincé.
◉ Contrôle de qualité
- Etalez une mince couche de selles sur une lame et colorez là. Il doit apparaître de nombreuses bactéries Gram positif et négatif.
☰ Remarque : Il est recommandé de réaliser, avec la même préparation de selles diluées, une ou plusieurs dizaines de lames que l'on sèche, que l'on fixe et qu'on emballe séparément avec du papier aluminium . On les conserve à +4°C. Cela permet d'éliminer le paramètre : épaisseur du frottis et de se concentrer sur la qualité des réactifs et sur les temps de coloration et de décoloration.
◉ Comentaires et Astuces
- L'épaisseur du frottis utilisé affectera le résultat de la coloration. L'étape la plus cruciale pour obtenir le résultat de la coloration est l'étape de décoloration.
- Une décoloration excessive entraînera un résultat erroné où les frottis Gram positives peuvent apparaître rose ou rouge indiquant un résultat Gram négatif, et une décoloration insuffisante conduira à un résultat erroné où les frottis Gram négatives peuvent apparaître de bleu à violet indiquant un Gram positif.
- Le degré de décoloration requis est déterminé par l'épaisseur du frottis.
- Le groupe ( #ASM ) recommande que les cellules soient préparées avec un frottis mince sans zones d'agglutination ou d'incohérence. Lors de la coloration du frottis mince, un court temps de décoloration doit être utilisé.
- Certaines personnes inondent la diapositive pendant 15 secondes ou moins avec un agent décolorant, tandis que d'autres recommandent d'ajouter l'agent décolorant goutte à goutte pendant 5 à 15 secondes ou jusqu'à ce que la couleur de l'agent décolorant qui s'écoule de la diapositive ne montre plus aucune couleur.
- Il est recommandé d'utiliser de jeunes cultures en croissance active . Une paroi cellulaire intacte est requise pour une précise. Les cultures plus anciennes peuvent avoir des cassures dans la paroi cellulaire et donnent souvent des résultats à Gram variable où un mélange de cellules.
- Le test de l'hydroxyde de potassium 'KOH' peut être utilisé comme test de confirmation pour la coloration de Gram La formation d'une chaîne (ADN) dans 3% de KOH indique que l'isolat est un organisme Gram négatif ( Les parois cellulaires à Gram négatif sont décomposées par 3% de KOH et libèrent à leur tour un matériau chromosomique viscoïde qui fait que la suspension devient épaisse et filandreuse.)
- 1- Une goutte de 3% KOH sur une lame microscopique.
- 2- Transférer une quantité généreuse de bactéries (cultivées pendant 24-48 h) à la goutte de KOH Remuer soigneusement
- 3-La solution de bactéries à Gram négatif sera visqueuse et formera une chaîne mucoïde dans les 30 secondes

KOH test positif
◉ Les bactéries Gram positif et les bactéries Gram négatif
| Description du Morphotype | Organismes les plus courants |
|---|---|
| Cocci à Gram positif | |
| Paires | Staphylococcus, Streptococcus, Enterococcus spp. |
| Tétrades | Micrococcus, Staphylococcus, Peptostreptococcus spp |
| Groupes | Staphylococcus, Peptostreptococcus, Stomatococcus spp. |
| Chaînes | Streptococcus, Peptostreptococcus spp. |
| Clusters, intracellulaires | Streptococcus spp. Microaérophile, streptocoques viridans, Staphylococcus spp. |
| Encapsulé | Streptococcus pneumoniae, Streptococcus pyogenes (rarement), Stomatococcus mucilaginosus |
| En forme d'ancet | Streptococcus pneumoniae |
| Cocci à Gram negatif | |
| Neisseria spp., Moraxella catarrhalis. | |
| Bacilles à Gram positif | |
| Petit | Listeria monocytogenes, Corynebacterium spp. |
| Moyen | Lactobacillus, bacilles anaérobies |
| Grand | Clostridium, Bacillus spp. |
| Diphtéroïde | Corynebacterium, Propionibacterium, Rothia spp. |
| Pléomorphe, Gram variables | Gardnerella vaginalis |
| Perlé | Mycobactéries, lactobacilles affectés par les antibiotiques et corynébactéries |
| Filamenteux | Morphotypes anaérobies, cellules affectées par les antibiotiques |
| Filamenteux, perlé, ramifié | Actinomycetes, Nocardia, Nocardiopsis, Streptomyces, Rothia spp. |
| Formes bifides ou en V | Bifidobacterium spp., brevibacteria |
| Coccobacilles à Gram négatif | Bordetella, Haemophilus spp. (pléomorphe) |
| Masses | Veillonella spp. |
| Chaînes | Prevotella, Veillonella spp |
| Bacilles à Gram négatif | |
| Petit | Haemophilus, Legionella (thin with filaments), Actinobacillus, Bordetella, Brucella, Francisella, Pasteurella, Capnocytophaga, Prevotella, Eikenella spp. |
| Bipolaire | Klebsiella pneumoniae, Pasteurella spp., Bacteroides spp. |
| Moyen | Entériques, pseudomonas |
| Grand | Clostridia ou bacilles dévitalisés |
| Incurvée | Vibro, Campylobacter spp. |
| Spirale | Campylobacter, Helicobacter, Gastrobacillum, Borrelia, Leptospira, Treponema spp |
| Fusiforme | Fusobacterium nucleatum |
| Filaments | Fusobacterium necrophorum (pléomorphe) |
◉ Questions fréquemment posées
Q : Qui est l'auteur de la coloration Gram ?
R : La coloration de Gram doit son nom au bactériologiste danois Hans Christian Gram (1853 - 1938) qui mis au point le protocole de la coloration en 1884.
Q : Quelles sont les 4 étapes de la coloration de Gram ?
R : La coloration de Gram consiste à colorer les bactéries, à fixer la couleur avec un mordant, à décolorer les bactéries et à appliquer une contre-coloration.
Pour certains auteurs, ils considèrent qu'il y a 5 étapes de coloration de Gram dont la première est la réalisation d'un frottis de bactéries sur une lame, puis la coloration des bactéries, la fixation, la décoloration et enfin la contre-coloration.
Q : Quels sont les 2 types de coloration de Gram ?
R : Deux grands groupes : gram-positif et gram-négatif
Q : Pourquoi Dit-on que la coloration de Gram est une coloration différentielle ?
R :Elle est dite une coloration différentielle parce qu'elle permet de différencier les bactéries selon 2 critères principaux : leur forme (paires, tétrades, groupes, chaînes...) et leur affinité pour les colorants (: gram-positif et gram-négatif).
Q : De quelle couleur est gram négatif ?
R : Les organismes gram-négatifs sont de couleur rose - rouge.
Q : De quelle couleur est gram positif ?
R : Les organismes Gram-positifs sont de couleur violette ou bleue
Q : Pourquoi l'iode est-il utilisé dans la coloration de Gram ?
R :L'iode est ajouté comme mordant pour la fixation du colorant, il former le complexe cristal violet-iode afin que le colorant ne puisse pas être éliminé.
Q : Pourquoi l'alcool est-il utilisé dans la coloration de Gram ?
R : Les parois cellulaires à Gram négatif contiennent une forte concentration de lipides solubles dans l'alcool. Le décolorant dissout les lipides, augmentant la perméabilité de la paroi cellulaire et permettant au complexe cristal violet-iode de s'écouler hors de la cellule.