Beta-lactamines | Structure | Mécanisme d’action |
Spectre
d’activité
Contenu :
- Mécanisme d’action de Beta-lactamines
- Classification des Beta-lactamines
- Les dérivés de l’acide 6-amino-pénicillanique,
- Pénames
- Groupe de la
pénicilline G
- Groupe de la
pénicilline M
-
Pénicillines du
groupe A
- Les
carboxypénicillines
- Les
acyluréidopénicillines
- Les
amidinopénicillines
- Pénicillines
sulfones
-
Oxapénames ou
clavames
-
Carbapénèmes
- Les
dérivés de l’acide
7-amino-céphalosporanique,
- Céphalosporines de premiére
génération
- Céphalosporines de deuxième
génération
- Céphalosporines de
troisième génération
- Céphalosporines de
quatrième génération
- Les nouvelles
céphalosporines
- Les monobactames.
◉ Introduction
La famille des β-lactamines comprend un grand nombre de molécules, toutes caractérisées par :
- La présence d’un cycle β-lactame, indispensable à l’activité antibiotique.
- Une faible toxicité, rendant ces molécules compatibles avec une utilisation clinique étendue.
- Un mode d’action complexe sur des protéines spécifiques de la membrane cytoplasmique, appelées protéines liant la pénicilline (PLP, pour penicillin-binding proteins).
◉ Mécanisme d’action de Beta-lactamines
Les β-lactamines agissent en perturbant les étapes finales de la synthèse du peptidoglycane, composant essentiel de la paroi bactérienne :
Analogies structurales
Les β-lactamines présentent une similitude structurelle avec le dipeptide terminal
D-alanine-D-alanine, présent dans le pentapeptide constitutif du peptidoglycane.
Reconnaissance enzymatique
Cette structure permet leur reconnaissance par les transpeptidases et carboxypeptidases (ou PLP).
Ces enzymes, impliquées dans la réticulation du peptidoglycane, possèdent un site actif contenant souvent une sérine.
Fixation au site actif
Le cycle β-lactame se fixe de manière covalente sur le site actif, entraînant une ouverture du cycle β-lactame
et une acylation du site actif sérine. Cela forme un complexe pénicilloyl-enzyme stable.
Inhibition enzymatique irréversible
Cette fixation inhibe définitivement le site actif, bloquant la synthèse du peptidoglycane.
En conséquence, la paroi bactérienne devient instable, ce qui entraîne un arrêt de la croissance bactérienne et, souvent, la lyse cellulaire.
Note : Les β-lactamines ne perturbent pas les étapes de transglycosylation, qui consistent en l’élongation des chaînes de peptidoglycane.
Substrat suicide
Les β-lactamines agissent comme des "substrats suicide", détruisant l’enzyme cible au cours de l’interaction.
◉ Classification des Beta-lactamines
Les β-lactamines sont classées en fonction
de la
nature du noyau
entrant dans leur structure de base.
La structure du noyau de base, qui comporte
toujours le cycle
β-lactame, permet de répartir ces produits en
trois grands
groupes:
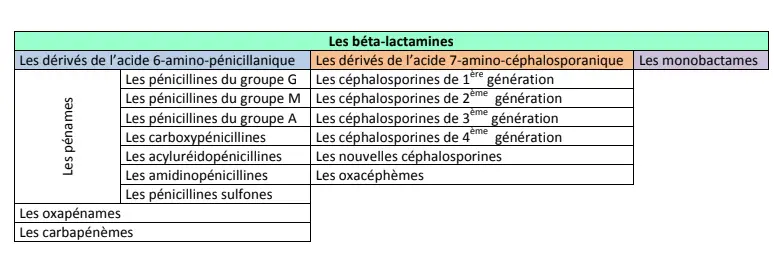
1-Les dérivés de
l’acide
6-amino-pénicillanique
❶ Pénames:
☰ Leur noyau de base associe un cycle β-lactame à un cycle
thiazolidine,
spécifique des
pénicillines (Noyau péname) .
❶- A. Groupe de la pénicilline G
☰ Structure de la pénicilline G
La benzylpénicilline connue sous le nom de pénicilline G, possède un acide
phénylacétique en
position 6. Elle ne passe pas la barrière digestive car elle est
rapidement hydrolysée
en milieu acide et ne peut donc pas être utilisée par voie orale.
La modification de cette chaîne latérale en 6 par une liaison oxygène aboutit
à des composés
plus stables : les phénoxyméthylpénicillines (pénicillines V) qui
peuvent être utilisés
par voie orale.
☰ Spectre d’activité de la pénicilline G
Toutes ces pénicillines ont une activité identique contre les cocci
à Gram
positif et
négatif, ainsi que contre quelques bacilles à Gram positif comme les
Corynébactéries ou
les Clostridium.
Les bacilles à Gram négatif, naturellement résistants par imperméabilité, ne
sont inhibés que
par de très fortes concentrations qui ne peuvent pas être atteintes en
thérapeutique.
Les pénicillines G et V sont inactives sur les staphylocoques producteurs de
pénicillinase.
❶- B. Groupe de la pénicilline M :
Pénicillines
anti-staphylococciques
☰ Structure de la pénicilline M
L’addition de nouvelles chaînes en position 6 au noyau péname a permis
d’empêcher
l’attachement des pénicillinases des staphylocoques (un encombrement
stérique autour du
noyau bêtalactame) et ainsi d’obtenir des pénicillines qui résistent à
l’hydrolyse.
Le premier produit obtenu, la méticilline n’était administrable que par voie
parentérale du
fait d’une destruction rapide par les sucs gastriques, alors que
l’oxacilline, la
cloxacilline, la dicloxacilline ou la flucloxacilline sont utilisables
par voie orale.
☰ Spectre d’activité de la pénicilline M
Le même que celui de la pénicilline G et ses dérivés. Cependant, en dehors de
S. aureus
producteur de pénicillinase (plus de 90 % des S. aureus), ces produits
ont une moins
bonne activité intrinsèque que la pénicilline G et ses dérivés.
❶- C. Pénicillines du groupe A : Les
amino-pénicillines
☰ Structure pénicillines du groupe A
La première des amino-pénicillines, l’ampicilline (ou aminobenzylpénicilline)
a été obtenue en
modifiant la benzylpénicilline par le branchement d’un radical aminé
(NH2) sur sa chaîne
latérale en position 6.
Cette modification lui confère une meilleure stabilité en milieu acide et
élargit le spectre.
L’amoxicilline, analogue structural de l’ampicilline, a comme avantages une
meilleure
pharmacocinétique, une meilleure absorption orale et une activité plus
rapidement
bactéricide que l’ampicilline.
☰ Spectre d’activité pénicillines du groupe A
- Actives sur de nombreux bacilles à Gram négatif non naturellement
producteurs de
β-lactamases constitutives comme Escherichia coli, Proteus mirabilis,
Salmonella
enterica, Shigella spp..
- L’activité est plus forte que celle de la pénicilline G sur les
streptocoques et sur
Enterococcus faecalis.
- Inactivées par les pénicillinases y compris celle du staphylocoque.
- Inactives sur les bacilles à Gram négatif naturellement producteurs de
céphalosporinases
(certaines entérobactéries, Pseudomonas aeruginosa, Acinetobacter
baumannii).
❶- D. Les carboxypénicillines
☰ Structure carboxypénicillines
Ces pénicillines ont un groupement carboxyl (COOH) sur la chaîne latérale en
C6 en position α
de l’acide 6-amino-pénicillanique. La présence d’un groupement benzyl
différencie la
carbénicilline de la ticarcilline qui a un groupement thiényl.
☰ Spectre d’activité carboxypénicillines
Les carboxypénicillines (carbénicilline, ticarcilline) sont des produits
administrés par voie
parentérale (et inactifs per os) qui se différencient des
aminopénicillines par un
spectre encore plus étendu sur les bacilles à Gram négatif, englobant en
particulier
Pseudomonas aeruginosa, Acinetobacter baumannii, ou des entérobactéries
comme les
Proteus indole positif, Serratia spp, Enterobacter spp ou Citrobacter
freundii.
Toutes ces espèces sont résistantes aux aminopénicillines par l’action
conjuguée de :
- -la barrière de perméabilité de leur membrane externe ;
- - l’hydrolyse dans l’espace périplasmique bactérien par une
β-lactamase constitutive
chromosomique.
Cependant, cette augmentation d’activité sur les bacilles à Gram négatif par
rapport aux
aminopénicillines est compensée par une activité plus faible sur les
bactéries à Gram
positif, en particulier E. faecalis et sur H. influenzae.
❶- D. Les acyluréidopénicillines
☰ Structure acyluréidopénicillines
Ces pénicillines ont en commun la substitution du groupement urée sur la
chaîne latérale en
C6 en position α de l’acide 6-amino-pénicillanique.
☰ Spectre d’activité acyluréidopénicillines
Ce sont des pénicillines à large spectre d’utilisation parentérale. Le
spectre d’activité de
ces molécules est très large car il conjugue celui des aminopénicillines
et celui des
carboxypénicillines. La pipéracilline est le produit qui présente les
meilleures
activités in vitro.
❶- F. Les amidinopénicillines
☰ Structure amidinopénicillines
Les amidinopénicillines diffèrent des autres pénicillines par la substitution
d’une liaison
méthylène en C6 sur le noyau péname.
Le pivmécillinam, ester oral du mécillinam, est la seule amidinopénicilline
actuellement
disponible.
☰ Spectre d’activité amidinopénicillines
Cette substitution les rend très actives sur certaines entérobactéries des
voies urinaires
avec une affinité particulière pour les PLP2 d’E. coli, mais peu actives
sur l’ensemble
des bactéries à Gram positif.
❶- G. Pénicillines sulfones
Les principaux composés de ce sous-groupe sont le sulbactam et le tazobactam.
☰ Structure Pénicillines sulfones
Ces deux produits sont très proches et présentent une sulfonation en position
1 sur le noyau
péname. Ils diffèrent essentiellement par une substitution de la chaîne
latérale en
position 2.
☰ Spectre d’activité Pénicillines sulfones
Bien qu’ayant une activité antibactérienne propre à de fortes concentrations,
ce sont surtout
des inhibiteurs de β-lactamases par attachement et formation de
complexes covalents
irréversibles qui aboutissent à l’inactivation du site actif d’un grand
nombre de
β-lactamases appartenant essentiellement à la classe A de Ambler.
❷ Oxapénames ou clavames
☰ Structure de l’acide clavulanique
Le noyau clavame dérive du noyau péname par substitution du soufre en
position 1 par un
oxygène.
Le seul représentant actuellement utilisé est l’acide clavulanique.
☰ Spectre d’activité de l’acide clavulanique
L’acide clavulanique a par lui-même une activité antibactérienne propre, mais
c’est surtout
un inhibiteur progressif et irréversible de la plupart des β-lactamases
de la classe A
d’Ambler en se fixant sur leurs sites actifs.
Il est administré en association avec une autre β-lactamine comme
l’amoxicilline ou la
ticarcilline, ce qui permet de récupérer au moins partiellement leur
activité en
présence de souches bactériennes productrices de β-lactamases.
❸ Carbapénèmes :
Imipénème, méropénème,
ertapénème,
doripénème
☰ Structure des carbapénèmes
Les carbapénèmes se distinguent des pénicillines (pénams) par la présence
d’un atome de
carbone au lieu d’un souffre en position 1 et d’une liaison insaturée en
C2-C3. Ils
dérivent de la thiénamycine, produite naturellement par Streptomyces
cattleya.
☰ Relation structure-activité des carbapénèmes
-L’introduction du carbone dans le noyau pentagonal renforce le pouvoir de
fixation aux
protéines cibles.
-Les carbapénèmes possèdent en position 6 un groupement hydroxyéthyle. Ce
groupement assure
une stabilité importante vis-à-vis de l’action d’une grande variété de
b-lactamases et
augmente l’activité vis-à-vis d’espèces.
-Des modifications de substituant en position 2 sont responsables d’un gain
d’activité in
vitro du méropénème et du doripénème sur les bacilles à Gram négatif.
NB: En raison d’une dégradation rapide in
vivo par la
dehydropeptidase (DHP-1) des tubules rénaux proximaux, l’imipénème doit
être
co-administré avec un inhibiteur de cette enzyme, la cilastatine qui
prévient en outre
la néphrotoxicité naturelle de l’antibiotique.
☰ Spectre d’activité des carbapénèmes
-Toutes les molécules sont actives in vitro sur les bactéries à Gram positif
sauf sur les
staphylocoques résistants à la méticilline et les entérocoques
(cependant, Seul
l’imipénème conserve une certaine activité vis-à-vis d’Enterococcus
faecalis)
-Les entérobactéries sont très sensibles aux carbapénèmes y compris les
souches BLSE ou
celles du groupe III productrices de céphalosporinase de haut niveau. En
général, les
CMI de l’imipénème vis à vis des entérobactéries sont plus élevées que
celles des 3
autres molécules.
-L’imipénème, le doripénème et le méropénème ont une activité comparable sur
P. aeruginosa et
A. baumannii , seule l’ertapénème n’a qu’une activité marginale sur ces
deux germes.
Vis-à-vis de P. aeruginosa, le doripénème est plus actif que les autres
carbapénèmes
-Les 4 molécules sont très actives sur l’ensemble des bactéries anaérobies à
Gram positif ou
à Gram négatif , en association avec l’amikacine sur Nocardia spp.
☰ Nouvelles molécules des carbapénèmes
❖ Imipénème-relebactam:
Le relebactam est un inhibiteur des béta-lactamases de classes A et C qui
permet de restaurer
l’efficacité in vitro de l’imipénème contre les entérobactéries
productrices de
carbapénèmases. En cours de développement, non disponible à la
commercialisation
Le relebactam est un inhibiteur des béta-lactamases de classes A et C qui
permet de restaurer
l’efficacité in vitro de l’imipénème contre les entérobactéries
productrices de
carbapénèmases. En cours de développement, non disponible à la
commercialisation
❖ Méropénème-varbobactam
Le varbobactam est un inhibiteur des béta-lactamases de classes A, C et
certaines D.
L’association est peu active sur les P. aeruginosa
carbapénèmes-résistant et inactif sur
A baumannii
L’association n’est pas encore commercialisée dans l’attente des résultats
des études
cliniques de phase III.
❖ Méropénème-nacubactam
:
Le nacubactam est un nouveau inhibiteur de bêta-lactamase a un double mode
d’action:
- -en tant qu’inhibiteur des sérine bêta-lactamases (classes A, C et
D)
- - en tant qu’inhibiteur de la PLP2 d’Enterobactéries entraînant une
activité antibactérienne qui peut en outre se traduire par un
Effet «activateur» en association avec les bêta-lactamines.
2- Dérivés de l’acide
7-amino-céphalosporanique :
Leur noyau de base associe un cycle β-lactame à un cycle dihydrothiazine
(noyau céphème). On
retrouve au sein de ce groupe l’ensemble des céphalosporines.
Suivant les substitutions effectuées sur les carbones du noyau céphème, on
modifie soit la
stabilité aux b-lactamases (radicaux R1, R3, R4), soit l’activité
intrinsèque (radical
R1 et/ou R2) ou la pharmacocinétique (radical R2).
D’autres substitutions peuvent modifier la vitesse de pénétration au travers
des porines de
la membrane externe, l’affinité de l’antibiotique pour les PLP ou son
pouvoir inducteur
sur les b-lactamases constitutives.
❶ Céphalosporines de
premiére génération
☰ Spectre d’activité Céphalosporines de
premiére génération
-Cocci à Gram positif, essentiellement les streptocoques et les
staphylocoques sensibles à la
méthicilline
-Quelques entérobactéries ne produisant pas de céphalosporinase inductible
comme E. coli, les
salmonelles, P. mirabilis ou Klebsiella spp.
Elles sont hydrolysées facilement par les β-lactamases acquises.
❷ Céphalosporines de
deuxième génération
☰ Spectre d’activité Céphalosporines de
deuxième génération
Ils ont un spectre un peu élargi au sein des entérobactéries avec des
variations suivant les
molécules.
Les céphamycines comme la céfoxitine et le céfotétan leur sont rattachées du
fait de leur
spectre très proche étendu à certaines entérobactéries productrices de
β-lactamase à
spectre étendu et aux anaérobies à Gram négatif.
. Les céphamycines présentaient l’avantage par rapport aux classes
précédentes de
céphalosporines, d’une plus grande résistance à l’hydrolyse des
β-lactamases de classe A
en particulier les pénicillinases de type TEM et SHV.
Elles sont actives sur les staphylocoques sensibles à la méthicilline, sur S.
pneumoniae
sensible à la pénicilline mais sans gain notable par rapport aux
céphalosporines de
première génération.
Inactives sur Pseudomonas aeruginosa.
❷ Céphalosporines de
troisième
génération
☰ Spectre d’activité Céphalosporines de troisième
génération
Ces céphalosporines se caractérisent par une puissante activité
antibactérienne vis-à-vis
d’Haemophilus, des entérobactéries, de Neisseria meningitidis et
de
Neisseria
gonorrhoeae.
Leur action sur les bactéries à Gram négatif est dix à 100 fois plus
puissante que celle des
céphalosporines de première et deuxième générations. En outre,
leur
spectre inclut les
cocci à Gram positif comme les streptocoques β-hémolytiques des
groupes
A, B, C, G et
Streptococcus pneumoniae pour certaines d’entre elles.
La plupart d’entre elles, comme le céfotaxime, la ceftriaxone, la
ceftizoxime, le céfixime ou
le cefpodoxime ont cependant une activité restreinte sur P.
aeruginosa
et Acinetobacter
spp.
❏ Céfotaxime :
La substitution en R1 par un hétérocycle amino-2-thiazolyl accroît
l’activité
antibactérienne
vis-à-vis des bacilles à Gram négatif. Il permet une acylation
maximale
et irréversible
des transpeptidases pariétales avec une augmentation de
l’affinité pour
les PLP3 des
entérobactéries.
La présence de ce volumineux radical confère par l’encombrement
stérique du
noyau β-lactame
une certaine résistance à l’hydrolyse par les β-lactamases.
L’introduction sur la chaîne latérale branchée sur le carbone 7 en
position α
d’un groupement
méthoxy-imino augmente considérablement la stabilité vis-à-vis
des
β-lactamases.
❏ Ceftazidime :
Pour la ceftazidime, l’introduction de l’hétérocycle pyridinium
chargé
positivement en
position 3 associé à une charge négative en 7 favorise le
passage à
travers la membrane
externe de P. aeruginosa. Egalement
elle possède un groupement carboxypropyl-oxy-imino en position
latérale qui
protège davantage
le noyau β-lactame des β-lactamases de P. aeruginosa et renforce
son
activité vis-à-vis
de cette espèce mais la présence de ce radical carboxy diminue
l’affinité pour les PLP
des streptocoques et des staphylocoques par rapport aux autres
molécules.
❏ Céfopérazone :
La présence du radical α-pipérazine-dione en R1 assure une forte
élimination
biliaire,
augmente l’activité contre P. aeruginosa, mais confère une
activité
inférieure sur les
entérobactéries due à une moindre résistance aux β-lactamases
plasmidiques de type TEM
très fréquentes chez les entérobactéries.
La présence en position 3 du méthyl-thiotétrazole s’accompagne d’une
augmentation de
l’affinité pour les PLP3.
❏ Cefsulodine :
C’est une céphalosporine anti-Pseudomonas à spectre étroit. La bonne
activité
anti-Pseudomonas repose sur l’association d’une charge négative
en 7 et
d’une charge
positive sur l’azote du pyridinium : le radical R1 constitué
d’un
groupement
α-sulfo-phényl chargé négativement confère à la cefsulodine une
activité
accrue sur P.
aeruginosa et une faible activité sur les entérobactéries.
La présence d’une substitution du pyrimidium par un groupement
carbamoyl en
R2 assure une
grande stabilité à la dégradation par les diacétylases.
Nouvelle molécule : C3G + inhibiteur
de béta
lactamases
❖Ceftazidime-avibactam
(Zavicefta®):
Première association d’un nouvel inhibiteur de béta-lactamases à une
ancienne
béta-lactamine
à être autorisée par l’EMA(European medicines agency ) et la FDA
( food
and drugs
administration), la ceftazidime-avibactam est active sur la
majorité des
entérobactéries. En effet, l’avibactam inhibe l’activité de la
plupart
des
béta-lactamases (béta-lactamases de classe A, C et certaines D).
Néanmoins, il reste inefficace sur les métallo-béta-lactamases
(classeB) et
l’association
ceftazidime-avibactam est inactive sur la majorité des bactéries
à Gram
positif et les
anaérobies elle est aussi efficace que des carbapénèmes dans des
infections urinaires ou
intra-abdominales .
❹ Céphalosporines de
quatrième
génération
Présentent un gain d’activité sur les cocci à Gram positif, une
activité sur
P. aeruginosa et
une meilleure résistance à l’hydrolyse par les céphalosporines
hyperproduites.
Elles ont une faible affinité pour les céphalosporinases présentes
dans
l’espace
périplasmique de certaines espèces comme P. aeruginosa ou
Enterobacter
spp.
La présence du groupement polaire bicyclique cyclopentopyridinium
élargit le
spectre des
amino-2-thiazole méthoxy iminocéphalosporines (cefpirome) à P.
aeruginosa, à S. aureus
sensible à la méthicilline et à un moindre degré aux
entérocoques.
Nouvelle molécule :
❖Cefepime /
zidebactam
:
: a montré une activité puissante contre les entérobactéries et P.
aeruginosa
produisant
diverses b-lactamases y compris les BLSE, les KPC, les AmpC et
les MBL.
❺ Les nouvelles
céphalosporines
a-Ceftobiprole 5éme génération
• Spectre d’activité :
Une céphalosporine semi-synthétique a été obtenu à partir du noyau
cephem par
modifications
en C3 et C7 permettant d’augmenter sa liposolubilité, son
affinité pour
la protéine de
liaison aux pénicillines (PLP-) 2a et sa stabilité aux
β-lactamases. Il
est administré
sous la forme d’une prodrogue hydrosoluble : le ceftobiprole
medocaril.
• Spectre d’activité :
Il se traduit par une bactéricidie bien documentée vis-à-vis des
cocci Gram
+. Le
ceftobiprole inhibe également la croissance de nombreuses
entérobactéries, de certaines
souches de Pseudomonas aeruginosa et d’Acinetobacter sp., avec
un
spectre assez proche
de celui du céfépime vis-à-vis de ces bacilles Gram négatif
(BGN).
Ce n’est clairement pas dans cette indication que le ceftobiprole se
distingue des autres
β-lactamines à large spectre mais son activité vis-à-vis de
nombreux BGN
d’acquisition
nosocomiale pourrait permettre en théorie son utilisation en
monothérapie dans les
contextes où les SARM, les entérobactéries et les BGN non
fermentants
sont possiblement
en cause (neutropénies fébriles, pneumopathies acquises sous
ventilation, autres
infections nosocomiales sévères)
b-Ceftaroline : 5 éme génération
• Spectre d’activité :
La ceftaroline a été obtenue à partir de la modification de la
céphalosporine
de 4e
génération cefozoprane. La prodrogue, la ceftaroline fosamil,
est
rapidement convertie
dans le plasma dans la forme bioactive, la ceftaroline.
• Spectre d’activité :
La FDA a retenu un seuil de sensibilité à 1 —g/ml. Avec ce seuil de
sensibilité, les espèces
sensibles à la ceftaroline sont :
- Les bactéries à Gram positif : S. aureus, y compris les souches
résistantes
à la
méticilline, les staphylocoques coagulase négative, S.
pneumoniae y
compris pour le
PLP2x des souches de sensibilité diminuée à la pénicilline, S.
pyogenes,
S. agalactiae
- Les bactéries à Gram négatif : E. coli, K. pneumoniae, E. cloacae,
C.
freundii
- Les bactéries à Gram-positif naturellement résistantes sont E.
faecalis, E.
faecium.
- Parmi les bactéries à Gram négatif, P. mirabilis, Providencia sp.,
S.
marscecens, P.
aeruginosa, S. maltophilia, Acinetobacter sp. sont naturellement
résistantes.
La ceftaroline est dégradée par les céphalosporinases et les
bêta-lactamases
à spectre étendu
des entérobactéries productrices.
c-Ceftolozane-tazobactam (Zerbaxa®)
La ceftolozane-tazobactam est l’association d’une C5G à un ancien
inhibiteur
de
béta-lactamases. La ceftolozane est particulièrement active sur
les P.
aeruginosa y
compris les souches présentant de multiples résistances
(pipéracilline,aminosides,
fluoroquinolones, carbapénèmes, ceftazidime).
L’association avec le tazobactam permet d’être actif sur les
entérobactéries
productrices de
BLSE. Commercialisée en Europe et aux États-Unis, elle est
indiquée dans
le traitement
des infections intra-abdominales et urinaires compliquées.
d-Cefiderocol
Le cefiderocol est une céphalosporine sidérophore dont le mécanisme
d’action
est basé sur la
destruction de la paroi bactérienne grâce au complexe formé avec
l’ion
ferrique. In
vitro, il est actif sur l’ensemble des BGN y compris les
Acinetobacter
baumanii et P.
aeruginosa multirésistants.
Les résultats des premiers essais cliniques de phase III sont très
attendus.
À ce stade de
développement, il est considéré comme l’une des plus grandes
innovations
de ces
dernières années dans la lutte contre les BGN.
3- Monobactames :
• Spectre d’activité :
Le noyau des monobactames est limité au cycle b-lactame.
Le seul produit utilisé actuellement est l’aztréonam.
• Spectre d’activité :
Une chaîne latérale aminothiazolyl lui confère une très bonne
activité contre
les bactéries à
Gram négatif aérobies et plus particulièrement contre les
entérobactéries pour
lesquelles il possède une activité comparable à celle des
céphalosporines de troisième
génération en raison de sa bonne stabilité vis-à-vis des
β-lactamases.
Son activité
s’étend à P. aeruginosa.
Il n’a en revanche aucune activité sur les bacilles à Gram positif et
les
anaérobies.
• Nouvelles molécules :
❖Aztréonam-avibactam
:
L’aztréonam-avibactam associe une monobactame (l’aztréonam) non
hydrolysée
par les
métallo-béta-lactamases à un inhibiteur des béta-lactamases de
classes
A, C et certaines
D (l’avibactam).
Cette association permettrait d’assurer une efficacité sur l’ensemble
des
entérobactéries.
Elle actuellement en phase de développement .