Content :
Carbapénémases : la résistance enzymatique aux Carbapénémases
✑ Dr HAMZAOUI Lina
◉ Introduction
Les carbapénèmes sont des antibiotiques de dernière ligne utilisés pour traiter des infections graves causées par des bactéries multirésistantes, notamment Escherichia coli, Klebsiella pneumoniae et Pseudomonas aeruginosa. Leur efficacité en fait des médicaments essentiels dans les traitements des infections nosocomiales et des infections sévères. Toutefois, l'usage croissant et parfois inapproprié de ces antibiotiques a favorisé l'émergence de bactéries résistantes, notamment par la production de carbapénèmases, des enzymes capables de dégrader les carbapénèmes et de conférer ainsi une résistance.
Les carbapénèmases appartiennent à un groupe de β-lactamases qui se divisent en plusieurs classes en fonction de leurs propriétés structurales et enzymatiques. Ces enzymes sont responsables de la dégradation de la structure des carbapénèmes, empêchant ainsi l'action de l'antibiotique. Les carbapénèmases les plus fréquentes et les plus préoccupantes dans les infections nosocomiales sont celles de types KPC (Klebsiella pneumoniae carbapenemase), VIM (Verona integron-mediated metallo-β-lactamase), IMP (imipenemase), NDM (New Delhi metallo-β-lactamase) et OXA-48 (oxacillinase).
◉ Classification
❍ Selon la classification d'Ambler, les carbapénèmases peuvent être divisées en classes A, B et D.
- Les carbapénèmases de classe A sont des β-lactamases à sérine.
- Les carbapénèmases de classe B sont des métallo-β-lactamases (MBL) , caractérisées par la nécessité d'ions zinc sur leurs site actif .
- Les carbapénèmases courantes de classe D , β-lactamases à sérine, comprennent les enzymes de type OXA (OXA-48,OXA-23, OXA-40, OXA-58 et OXA-143 ..)
⛔ Bien que plusieurs des carbapénèmases de classe C ont été décrites (ACT-1, CMY-2, CMY-10, CMY-19, CMY-37 et ADC-68), leurs producteurs présentent généralement une sensibilité réduite aux carbapénèmes dû au faible efficacité catalytique de l'enzyme et d'un défaut de perméabilité. Par conséquent, ils ne sont pas considérés comme de véritables carbapénèmases (Nordmann, John Quale, Georgios Meletis)
Ambler classe A : Bush-Jacoby groupe fonctionnel 2
◈ Carbapénèmases classe A:
- GES-1, GES-2, SHV-38 : groupe fonctionnel 2be
- GES-5 : groupe fonctionnel 2br
- GES-4, KPC: groupe fonctionnel 2e
- SME, IMI/NMC-A: groupe fonctionnel 2f
Ambler classe B : Bush-Jacoby groupe fonctionnel 3
◈ Métallo-β-lactamases (MBL):
- Sous classe B1 : IMP, VIM, SPM, IND, NDM, DIM, GIM, SIM : groupe fonctionnel 3a
- Sous classe B2 : CphA, Sfh-I, ImiS : groupe fonctionnel 3b
- Sous classe B3 : AIM, CAU-1, GOB-1, FEZ-1 : groupe fonctionnel 3a
Ambler classe D : Bush-Jacoby groupe fonctionnel 2df
◈ CHDLs (carbapenem-hydrolyzing class D β-lactamases):
- OXA-28, OXA-48 , OXA-23-like, OXA-40-like, OXA-58-like et OXA-143-like
Ambler classe C : Bush-Jacoby groupe functionel 1e
◈ ESAC (extended-spectrum AmpC β-lactamases):
- CMY-10, CMY-19, CMY-37
Classification des carbapénémases (Sawa et al. 2020.)
Carbapénèmases de classe A
Les carbapénèmases de classe A, sérine carbapénèmases du groupe moléculaire (Ambler) A, détectées principalement chez les entérobactéries, appartiennent aux sous-groupes fonctionnels 2br, 2be, 2e et 2f selon le schéma de classification proposé par Bush et al.
Plusieurs types de carbapénèmases de classe A ont été rapportés. Ces carbapénèmases peuvent être codées de manière chromosomique, plasmidique, ou par les deux :
- Chromosomiques :
- SME (Serratia marcescens enzyme),
- NMC-A (non-metallocarbapenemase-A),
- SHV (sulfhydryl-variable lactamase),
- SFC-1 (Serratia fonticola carbapenemase).
- Plasmidiques :
- GES (Guiana extended-spectrum β-lactamase),
- KPC (Klebsiella pneumoniae carbapenemase).
- Les deux (mixte) :
- IMI (imipenemase).
⛔ Récemment, une intégration chromosomique du gène blaKPC a été montrée chez K. pneumoniae (Amy J Mathers).
Les variations du pouvoir hydrolytique entre les différentes classes et sous-classes enzymatiques rendent difficile leur catégorisation en se basant uniquement sur des données phénotypiques. Par exemple, pour le gène GES, parmi les 26 variants identifiés (Philipon, 2019), seulement 11 présentent une activité carbapénèmasique (Naas, 2016). Toutefois, de manière générale :
- Les bactéries exprimant ces enzymes hydrolysent de manière variable les pénicillines, les céphalosporines, les monobactames, et les carbapénèmes. Les CMI peuvent aller de légèrement élevées (CMI d'imipénème ≤ 4 µg/ml) à totalement résistantes. Elles sont inhibées par le clavulanate et le tazobactam, ces dernières étant mieux inhibées par le tazobactam que par l'acide clavulanique.
- L'aztréonam peut être dégradé par la plupart d'entre elles, à l'exception de GES-3 et GES-4.
- De plus, ces souches restent généralement sensibles (contrairement aux producteurs de carbapénèmases codées par des plasmides) à toutes les autres familles d'antibiotiques non bêta-lactamines (fluoroquinolones, aminosides, etc.).
- La famille KPC a le plus grand potentiel de propagation en raison de sa localisation sur des plasmides et peut hydrolyser les β-lactamines de toutes les classes. Le variant KPC-2 Asp179Asn a démontré une résistance non seulement à la ceftazidime et à l'imipénème, mais aussi à d'autres β-lactamines, y compris l'association ceftazidime-avibactam (Melissa D. Barnes )
- PenA peut hydrolyser les inhibiteurs ainsi que toutes les classes de bêta-lactamines.
◍ Substrat et profils d'inhibition des carbapénèmases classe A (Naas 2016) |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Enzyme | Nombre de variantes | Hôte | PEN | FOX | CEP-I | CEP-III | AZT | CARBA | A/Clavu |
| NmcA | 1 | E. cloacae | + | + | + | + | + | + | + |
| IMI-1-like | 8 | E. cloacae | + | - | + | - | + | + | + |
| SME-like | 6 | S. marcescens | + | - | + | +/- | + | + | + |
| SFC-1 | 1 | S. fonticola | + | + | + | - | + | + | - |
| BIC-1 | 1 | P. fluorescens | + | +/- | + | +/- | + | + | - |
| SHV-38 | 1 | K. pneumoniae | + | - | + | + | + | +/- | ++ |
| FPH-1 | 1 | F. philomiragia | + | - | + | + | + | + | +/- |
| PenA | 1 | B. multivorans | + | - | + | + | + | + | +/- |
| IMI-2 | E. asburiae, E. coli | + | - | + | - | + | + | +/- | |
| KPC-like | 22 | Enterobacteriaceae, P. aeruginosa, A. baumannii | + | +/- | + | + | + | + | +/- |
| GES-like | 23 | Enterobacteriaceae, P. aeruginosa, A. baumannii | + | +/- (a) | + | + | - (b) | +/- | +/- |
| FRI-1 | 1 | E. cloacae | + | - | + | + | + | + | + |
a + pour les variantes GES affichant une sérine en position 170; b Sauf variantes GES affichant une sérine ou une alanine en position 243; + : forte hydrolyse ; ± : faible hydrolyse ; - : aucune hydrolyse mesurable signalée
Carbapénèmases de classe B (Métallo-β-lactamases)
Les métallo-β-lactamases (MBL) diffèrent structurellement des autres β-lactamases par leur besoin d'un ion zinc au site actif. Les MBL présentent une faible affinité ou une faible capacité hydrolytique pour les monobactames et ne sont pas inhibées par l'acide clavulanique ni par le tazobactam. En revanche, elles sont inhibées par des chélateurs d'ions métalliques tels que l'EDTA, l'acide dipicolinique ou la 1,10-o-phénanthroline.
Ces MBL peuvent être classées en trois sous-classes (B1, B2, B3) en fonction de leur séquence d'acides aminés :
- Sous-classe B1 : Cette sous-classe (comprenant les enzymes IMP, VIM, NDM et SPM) est caractérisée par la présence de deux molécules de Zn²⁺ dans le centre actif de l'enzyme (Zn1, Zn2) et par la capacité à dégrader une large gamme de substrats. Elle est classée dans le sous-groupe fonctionnel Bush-Jacoby 3a.
- Sous-classe B3 : Cette sous-classe (comprenant les enzymes CAU-1, GOB-1 et FEZ-1) présente également deux molécules de Zn²⁺ au centre actif et a un spectre d’activité plus large que celui de la sous-classe B2. Elle appartient au sous-groupe fonctionnel Bush-Jacoby 3a.
- Sous-classe B2 : Cette sous-classe (comprenant les enzymes CphA, Sfh-I et ImiS) possède une seule molécule de Zn²⁺ dans le centre actif. Son spectre d’activité est plus étroit, se limitant principalement aux carbapénèmes et présentant une faible activité contre les pénicillines et les céphalosporines. Ces MBL sont classées dans le sous-groupe fonctionnel Bush-Jacoby 3b.
Carbapénèmases de classe D (Oxacillinases)
Les β-lactamases de classe D, également appelées enzymes de type OXA ou oxacillinases, comprennent plus de 350 enzymes génétiquement diversifiées.
Ces enzymes sont des sérine-β-lactamases, nommées oxacillinases en raison de leur capacité à hydrolyser rapidement les isoxazolylpénicillines par rapport aux autres pénicillines. Parmi celles-ci, certaines possèdent une activité carbapénèmasique (sous-groupe 2df de la classification de Bush), comme OXA-48, OXA-163, et OXA-181, qui sont faiblement inhibées par l'EDTA ou l'acide clavulanique.
Ces carbapénèmases se caractérisent par une faible activité contre les carbapénèmes, avec une hydrolyse plus rapide et efficace de l’imipénème par rapport au méropénème. Cependant, une résistance cliniquement significative est généralement observée en combinaison avec d'autres mécanismes tels que la perte de porines ou l'expression de pompes d'efflux.
Sur la base de l’identité de leur séquence d’acides aminés, les CHDLs (carbapenem-hydrolyzing class D β-lactamases) sont subdivisées en plusieurs sous-groupes. Les sous-groupes OXA-23, OXA-24/40, OXA-48, OXA-51, OXA-58, et OXA-143 sont particulièrement importants en raison de leur large diffusion dans des agents pathogènes bactériens d’importance clinique.
Les carbapénèmases de type OXA-48 hydrolysent efficacement les pénicillines et les carbapénèmes, mais pas les céphalosporines à spectre étendu. Cependant, elles sont souvent associées à des β-lactamases à spectre étendu (BLSE), conférant à la souche un phénotype de résistance aux céphalosporines similaire à celui observé chez les BLSE.
◉ Quand suspecter une carbapénèmase
Lors de la recherche de carbapénèmases, il est essentiel que les laboratoires maintiennent un haut niveau de suspicion tout en prenant en compte deux facteurs de confusion :
- Les isolats résistants aux carbapénèmes ne produisent pas forcément de carbapénèmase (la résistance peut être médiée par d'autres mécanismes).
- Les producteurs de carbapénèmase ne présentent pas toujours une résistance clinique aux carbapénèmes.
Quand suspecter une carbapénèmase selon EUCAST 2021
◈ Entérobactérie :
Certains isolats d’Enterobacterales producteurs de carbapénèmases (EPC) peuvent être classés S (sensibles à dose standard) aux carbapénèmes et doivent être rapportés comme tels. Toutefois, la détection des carbapénèmases reste recommandée pour des raisons épidémiologiques.
Toute souche présentant une sensibilité diminuée (I : sensible à forte posologie) ou une résistance (R) à au moins un carbapénème doit être considérée comme potentiellement productrice de carbapénèmase.
L’ertapénème est le carbapénème ayant la meilleure sensibilité pour détecter les EPC. Ainsi, toute souche présentant une diminution de sensibilité à l’ertapénème (diamètre d’inhibition < 25 mm avec un disque de 10 μg, par diffusion sur gélose) doit être soumise à un algorithme de détection des carbapénèmases.
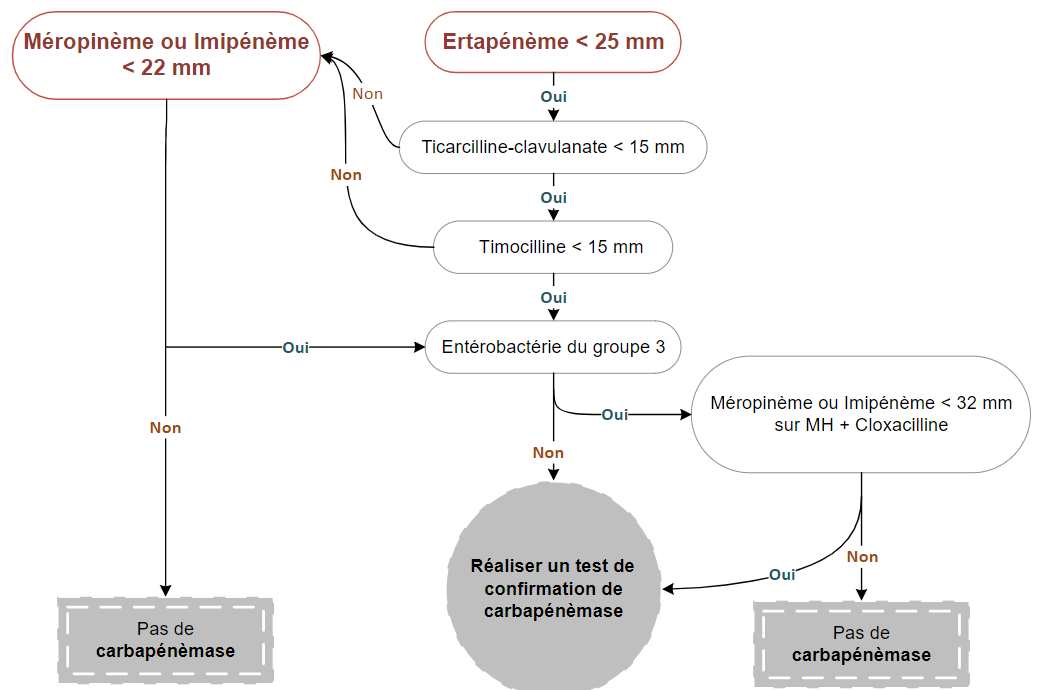
Algorithme phénotypique de criblage des souches d’Enterobacterales productrices de carbapénémases (Source : CA-SFM / EUCAST 2021)
◈ Pseudomonas :
Une diminution de la sensibilité à l’imipénème (diamètre d’inhibition < 20 mm) combinée à une résistance à l’association ceftolozane-tazobactam (diamètre < 24 mm) suggère fortement la présence d’une carbapénèmase.
Quand suspecter une carbapénèmase selon CLSI 2020
Les isolats producteurs de carbapénèmases sont généralement I (intermédiaires) ou R (résistants) à une ou plusieurs carbapénèmes, selon les seuils de CMI ou de diamètres d'inhibition suivants :
Diamètre d'inhibition et CMI pour les carbapénèmes |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Espèces | Agent antibactérien | Contenu du disque | S | I | R | S | I | R | |
| Entérobactéries | Doripenem, Imipenem, Meropenem | 10 μg | ≥ 23 | 20–22 | ≤ 19 | ≤ 1 | 2 | ≥ 4 | |
| Ertapenem | 10 μg | ≥ 22 | 19–21 | ≤ 18 | ≤ 0.5 | 1 | ≥ 2 | ||
| Pseudomonas | Doripenem, Imipenem, Meropenem | 10 μg | ≥ 19 | 16-18 | ≤ 15 | ≤ 2 | 4 | ≥ 8 | |
◉ Détection des carbapénèmase
L’objectif principal de la détection est de reconnaître efficacement tous les producteurs de carbapénèmases et de les différencier des isolats résistants aux carbapénèmes en raison d'autres mécanismes de résistance.
Les tests doivent être réalisés lorsque des isolats d’entérobactéries sont suspects de production de carbapénèmase, sur la base des critères suivants :
- CMI d'imipénème ou de méropénème : 2 à 4 µg/ml
- CMI d’ertapénème : 2 µg/ml
Certaines études (Fernando) ont montré que le dépistage basé sur la CMI est associé à une sensibilité plus élevée (100 % contre 84 %) que le dépistage basé sur le diamètre de la zone d'inhibition.
Hodge test modifié
Le test de Hodge modifié (Modified Hodge Test, MHT) a longtemps été une méthode de référence pour détecter les carbapénèmases. Son principe repose sur l'inactivation d'un carbapénème par une souche testée. Cette inactivation permet à une souche indicatrice sensible (généralement Escherichia coli) de croître en direction d’un disque contenant l’antibiotique, le long de la strie d’inoculum de la souche suspecte.
Le MHT a démontré une excellente sensibilité dans la détection des carbapénèmases de classe A et de classe D, atteignant entre 93 % et 98 %. Cependant, il est beaucoup moins performant pour la détection des métallo-β-lactamases (MBL) de classe B, avec une sensibilité d’environ 50 %. Cette faible efficacité est attribuée à l’ancrage des MBL dans la membrane externe bactérienne, ce qui limite leur diffusion.
Malgré son utilité historique, le MHT présente plusieurs inconvénients. Il est parfois difficile à interpréter, en raison de résultats ambigus, et nécessite un délai de 24 heures pour obtenir les résultats. Ces limitations, combinées à l’émergence de nouvelles méthodes phénotypiques plus précises, ont conduit à son retrait des recommandations du document CLSI M100 en 2018.
Hodge test modifié
Test Carba NP
Le test Carba NP, mis au point par Nordmann et Poirel en 2012, est une méthode phénotypique utilisée pour la détection des carbapénèmases. Son principe repose sur l'hydrolyse de l'imipénème par un lysat bactérien, qui entraîne une diminution du pH. Ce changement de pH est détecté grâce à l'indicateur rouge de phénol, provoquant une modification de la couleur de la solution (du rouge au jaune ou orange). Le résultat est généralement obtenu en environ deux heures.
L'hydrolyse de l'imipénème génère un dérivé carboxylique, responsable de l'acidification du milieu. Ce phénomène est visualisé par la transition de couleur de l'indicateur, confirmant la présence d'une carbapénèmase.
Le test Carba NP affiche une sensibilité et une spécificité élevées (supérieures à 90 %) pour détecter divers types de carbapénèmases, notamment KPC, NDM, VIM, IMP, SPM et SME. Toutefois, des résultats faussement négatifs peuvent survenir, particulièrement avec des souches mucoïdes ou des enzymes à faible activité carbapénèmase, comme celles de type OXA-48.

Test Carba NP : (droite) negatif ; (gauche) positif
Depuis sa création, de nombreuses variantes du test Carba NP ont été développées, intégrant des modifications de l'inoculum, des réactifs d'extraction, du pH initial, des indicateurs de pH ou encore des temps de lecture. Parmi ces adaptations, le test Carba NP-direct, proposé par Tijet et ses collègues, s’est révélé plus simple, rapide et sensible. Ce dernier a démontré une excellente performance, notamment dans la détection des carbapénèmases de type OXA, avec un taux de détection de 95 % pour les souches Acinetobacter spp. productrices d'enzymes de type OXA.
Méthode d'inactivation des carbapénèmes
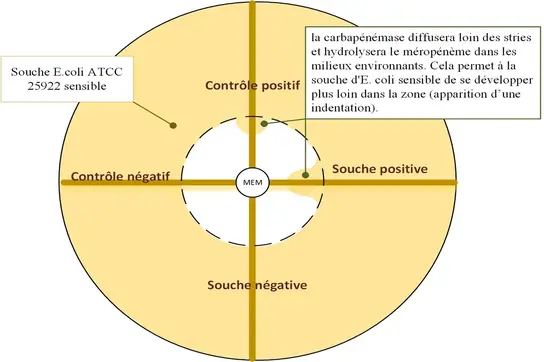
Le test CIM (Carbapenem Inactivation Method) a été décrit pour la première fois en 2015. Ce test repose sur un principe simple : un disque de méropénème (MEM) de 10 µg est incubé pendant 2 heures dans une suspension aqueuse contenant le microorganisme à tester. Si ce microorganisme produit une carbapénèmase, le MEM sera dégradé. À l’inverse, si aucune carbapénèmase n’est produite, le MEM conservera son activité antimicrobienne.
Après incubation, le disque est retiré de la suspension et placé sur une gélose Mueller-Hinton préalablement ensemencée avec une suspension d’un organisme indicateur sensible aux carbapénèmes. Après une nuit d'incubation, la zone d'inhibition autour du disque est mesurée :
- Une hydrolyse du MEM (croissance de l'organisme indicateur proche du disque) indique la présence de carbapénèmase.
- Une large zone d'inhibition signale que le MEM est toujours actif, excluant ainsi la présence de carbapénèmase.

Les résultats positifs ont montré l'absence d'une zone d'inhibition (A) et les résultats négatifs sont apparus > 20 mm de diamètre de zone d'inhibition (B).
Depuis son introduction, la méthode CIM a été adaptée sous plusieurs formes :
- mCIM (modified Carbapenem Inactivation Method) : une version modifiée pour améliorer sa sensibilité et sa reproductibilité.
- eCIM (EDTA-modified Carbapenem Inactivation Method) : cette version utilise l'EDTA pour détecter spécifiquement les métallo-β-lactamases (MBL).
- sCIM (Simplified Carbapenem Inactivation Method) : une méthode simplifiée pour une mise en œuvre plus rapide et pratique.
◉ Conclusion
Les carbapénèmases représentent une menace majeure pour la santé publique en raison de leur capacité à hydrolyser presque toutes les classes de β-lactamines, y compris les carbapénèmes, qui sont souvent utilisés en dernier recours dans le traitement des infections graves.
Leur détection rapide, via des méthodes phénotypiques et moléculaires, est essentielle pour guider le traitement et limiter leur propagation. Une approche combinant surveillance, gestion prudente des antibiotiques et développement de nouvelles thérapies est indispensable pour contrer cette résistance.
Références:
- Accurate Detection and Easy Interpretation of Carbapenemase Production in Enterobacteriaceae and Pseudomonas spp. (Carbapenem Inactivation Method)
- Modified Carbapenem Inactivation Method for Phenotypic Detection of Carbapenemase Production among Enterobacteriaceae.
- The Simplified Carbapenem Inactivation Method (sCIM) for Simple and Accurate Detection of Carbapenemase-Producing Gram-Negative Bacilli.
- Imipenem-EDTA Disk Method for Differentiation of Metallo-β-Lactamase-Producing Strains.
- Carbapenem resistance: overview of the problem and future perspectives.
- Interplay of efflux system, ampC, and oprD expression in carbapenem resistance of Pseudomonas aeruginosa clinical isolates.
- Extended-spectrum cephalosporinases: structure, detection and epidemiology.
- Characterization of OXA-48-like carbapenemase producers in Canada, 2011–14.
- OXA-48-like carbapenemases producing Enterobacteriaceae in different niches.
- OXA-48 Carbapenemase-Producing Enterobacterales in Spanish Hospitals.
- Class D β-Lactamases: Are They All Carbapenemases?
- Structure and Function of Serine and Metallo-β-lactamases and Their Inhibitors.
- Strategies for identification of carbapenemase-producing Enterobacteriaceae.
- Acquired Class D β-Lactamases.
- Structural and Functional Aspects of Class A Carbapenemases.
- Updated Functional Classification of β-Lactamases.
- Class A carbapenemases.
- Carbapenemases by Branka Bedenić and Sanda Sardelić.
- Carbapenemases: The Versatile β-Lactamases.
- Metallo-β-Lactamases: Structure, Function, Epidemiology, Treatment Options, and Development Pipeline.
- UK Standards: Laboratory Detection and Reporting of Bacteria with Carbapenem-Hydrolysing β-lactamases.