☰ Contenu :
- Ⅰ. Introduction:
- Ⅱ. Constituants chimiques:
- 1. Extraits de viandes
- 2. Peptones
- 3. Facteurs de croissance
- 4. Composants sélectifs / différentiels
- 5. Agar-agar ou gélose
- ⅠⅡ. Classification des milieux:
Ⅰ. Introduction
les milieux de cultures sont indispensables à la multiplication bactérienne, ce qui permet par la suite l’identification ainsi que l’étude de la sensibilité aux antibiotiques lorsque la bactérie est isolée en culture pure.
Un milieu de culture est une préparation au sein de laquelle des micro-organismes peuvent se multiplier. Il doit donc satisfaire les exigences nutritives du micro-organisme étudié et posséder les propriétés physico-chimiques convenant à cette culture:
- Couvrir les besoins en ions minéraux, en facteurs de croissance, apporter la source de carbone, d’énergie et d’azote.
- Présenter un pH voisin au pH optimal, une pression osmotique et une viscosité adéquate.
La pluspart de ces milieux microbiologiques sont produits par les principaux fournisseurs de milieux déshydratés, notamment Oxoid, HiMedia, BD Diagnostics et Millipore . Ceux-ci comprennent tous les milieux normalement utilisés dans le laboratoire de diagnostic de microbiologie clinique et pour l'examen de routine des aliments et de l'eau.
Ⅱ. Constituants chimiques des milieux de culture
La notion de milieu minimum : Un milieu minimum est un milieu comportant les éléments chimiques strictement nécessaires à la croissance bactérienne, sous une forme utilisable par des bactéries n'ayant pas d'exigence particulière :une source de carbone et d'énergie, une source de potassium, de phosphore, d'azote, de soufre, de magnésium, de calcium, de fer, d'oligo-éléments, d'eau et un tampon pH .
1. Extraits de viandes
Extraits de viandes est préparé à partir de tissus d’origine animal sélectionnés qui lui confèrent son excellente nutritivité.En association avec des peptones de différentes origines, l'extrait de viande constitue un excellent complément nutritif destiné à l'élaboration de milieux de culture variés. Il est habituellement incorporé à des concentrations allant de 0,2 à 1,0%.
Ces infusions contiennent des acides aminés et des peptides de faible poids moléculaire, des glucides, des vitamines, des minéraux et des métaux traces.
Exemple : Bacto extrait de boeuf déshydraté, Bacto Coeur de Bœuf pour Infusion

Extraits de viandes
2. Peptones
Les peptones sont des mélanges de composés solubles dans l’eau résultant de l’action d’enzymes ou acide protéolytiques sur des matières protéiques. Elles apportent au milieu de culture des acides aminés, des peptides (source d'énergie, de carbone, d'azote) principalement.
La caséine est le plus souvent utilisée comme substrat protéique pour former des peptones, mais d'autres substances, telles que la farine de soja, sont également couramment utilisées.
Exemple : Lait peptonisé, Protéose Peptone
3. Facteurs de croissance
L'incorporation de facteurs de croissance est utilisée pour enrichir les milieux de culture pour réussir la culture des micro-organisme exigeants. Le plus souvent, des mélanges de facteurs de croissance sont utilisés dans les milieux microbiologiques :
- Hydrolysats : ce sont des peptones obtenues par une action inorganique (Acide chlorhydrique) sur des protéines. Exemple : hydrolysat acide de caséine.
-
Extraits de levures : L'extrait autolytique de levure est considéré comme le principal facteur
d'enrichissement des milieux de culture.Elle est préparé sous forme d'extrait hydrosoluble de
cellules de
levure Saccharomyces cerevisiae autolysées. Au cours de l'autolyse, les enzymes digestives endogènes des levures décomposent la teneur en
protéines. De plus, l'extrait de levure fournit une source essentielle de vitamines du complexe B
hydrosolubles, de
glucides et d'acide glutamque libre.
En raison de sa teneur en glucides, il ne doit pas être utilisé dans les milieux destinés à l'étude des fermentations sucrées. - Produits biologiques : De nombreux milieux, en particulier ceux utilisés en laboratoire clinique, contiennent des produits biologique qui servent de nutriments essentiels pour les micro-organismes exigeants.
Exemple : Sang ou des composants sanguins, oeufs, lait de vache écrémé, sérum de cheval ou de bœuf .
4. Composants sélectifs / différentiels
La sélectivité : Les milieux de culture peuvent contenir des composants sélectifs qui inhibent la croissance de micro-organismes non ciblés. Ces milieux sont particulièrement utilisés pour l'isolement de micro-organismes spécifiques à partir de populations mixtes.
Plusieurs techniques sont utilisées pour rendre le milieux sélective :
- En ajoutant un composant toxique : sels biliaires, le sélénite, des concentrations élevées de chlorure.
- En ajoutant d'antibiotiques : le cycloheximide, la gentamicine, l'acide nalidixique, la vancomycine.
- En utilisant une seule source d’énergie.
La différenciation : Les milieux différentiels permettent de distinguer un type de micro-organisme d'un autre se développant sur le même milieu. ils contiennent des composés qui permettent de distinguer visuellement des groupes de micro-organismes par l'apparence de la colonie ou du milieu environnant,
- Certains milieux comprennent des indicateurs qui permettent la détection visuelle des changements suite à la production d'acide à partir de divers glucides et d'autres sources de carbone ou sur la décarboxylation d'acides aminés.
- D'autre milieux comprennent des colorants chromogéniques qui changent de couleur lorsque des réactions enzymatiques spécifiques se produisent.
5. Gélose ou Agar-agar
C’est un extrait d’algues rouges (rhodophycées) appartenant aux genres Gelidium et Gracilaria, récoltées dans les mers du Japon ou de Nouvelle-Zélande.
Chimiquement, la gélose est un mélange de deux groupes de polysaccharides dont l’un, dominant, est l’agarose : peu ou pas sulfaté, il a une propriété gélifiante.
La gélose se dissout dans l’eau vers 90°C, reste en surfusion jusqu’à 45°C ; puis à température basse, elle forme un gel transparent plus ou moins solide selon sa concentration dans l’eau. Elle n’est pas dégradée généralement par les micro-organismes (sauf rares bactéries et champignons).
Pour plus d'informations sur la gélose (Agar-agar)
Ⅲ. Classification des milieux de culture
Il existe une grande variété de milieux de culture , selon leur composition chimique, leur nature physique, leur utilisation ou la méthode de préparation, les milieux de culture peuvent être classés en plusieurs groupes
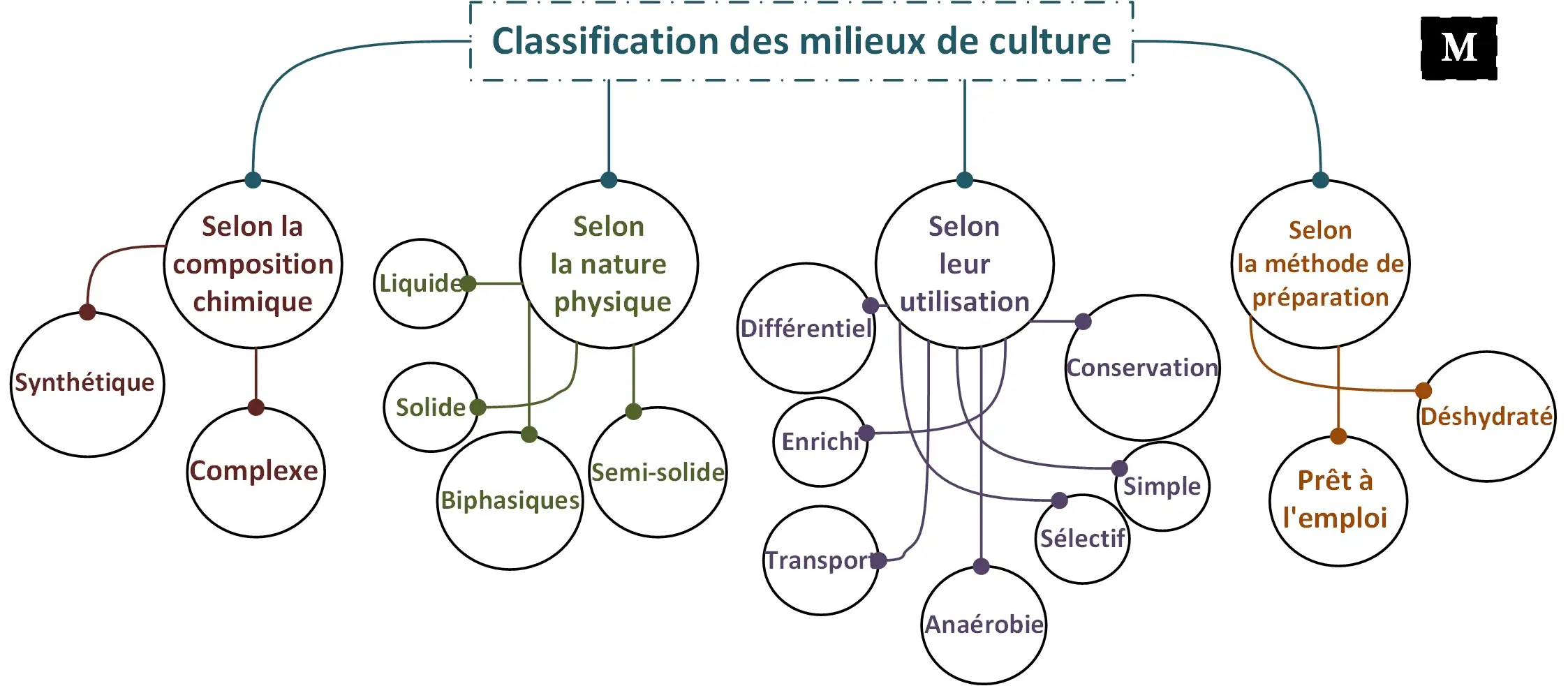
Classification des milieux de culture
◉. Classification des milieux de culture selon leur composition chimique
1. Milieu de culture empirique / Complexe / indéfini
De composition connue seulement avec approximation
, le milieu empirique contient des ingrédients complexes,
tels que l'extrait de levure ou l'hydrolysat de caséine,
dans des proportions inconnues.
Exemple : Bouillon LB, gélose Columbia ,
gélose Gassner, gélose Tryptycase soja
2. Milieu de culture synthétique / défini
Composition exactement connue, qualitativement et quantativement.
Ce sont des milieux chimiquement définis préparés à partir de substances chimiques pures. Un milieu synthétiques est entièrement
exempt de composants d'origine animale (y compris les composants d'origine microbienne tels
que l'extrait de levure). Ces milieux sont très utiles pour étudier la physiologie, la nature métabolique et les besoins nutritionnels des bacteries.
Exemple : Gélose citrate de Simons , milieu de glucose minéral.
◉. Classification des milieux de culture selon leur nature physique
1. Milieu de culture liquide
L'agar n'est pas ajouté lors de la préparation du milieu, la croissance se traduit par un trouble, un dépôt ou une voile superficielle. La présence de plus d'un type de bactéries ne peut pas être détectée et les cultures mixtes ne peuvent pas être séparés.
Exemple : bouillon nutritif, bouillon trypticase soja.
2. Milieu de culture semi-solide
Contenant 0.5-0.75 % d’agar de consistance molle, il est utilisé pour démontrer la motilité bactérienne.
Exemple: Milieu mannitol mobilité.
3. Milieu de culture solide
On obtient un milieu solide en ajoutant un agent gélifiant, "l’agar-agar" ou gélose, à un milieu liquide. Il permet l'identification des bactéries en étudiant les caractères des colonies (morphologie, pigmentation, l'hémolyse...) et Les cultures mixtes peuvent être séparées.
Exemple: Gélose nutritive, Gélose trypticase soja, Gélose Cled.
4. Milieu de culture biphasiques
Le milieu contient à la fois une partie solide et une partie liquide dans une seule bouteille. L'inoculum est ajouté au milieu liquide et lorsque des sous-cultures doivent être faites, la bouteille est simplement inclinée pour permettre au liquide de s'écouler sur le milieu solide.
Exemple: Flacon de Castaneda, système biphasique Middlebrook (gélose inclinée Middlebrook 7H11 + bouillon Middlebrook 9H).
◉ Classification des milieux de culture selon leur utilisation
1. Milieu de culture simple
Les milieux de cultures simple, base, sont ceux qui peuvent être utilisés pour la culture
de bactéries non exigeantes. Généralement utilisé dans le diagnostic de routine en laboratoire pour l'isolement
primaire des bactéries. Ce type de milieu peut être rendu plus riche, par l'ajout de supplements, ou sélective,
par l'ajout de concentrations variables de chlorure de sodium.
Exemple: Bouillon nutritif, gélose nutritive et eau peptonée
2. Milieu de culture enrichi
Ce sont des milieux utilisés pour l'obtention des bactéries dites « exigeantes » en y ajoutant de suppléments sous forme de sang, de sérum, de jaune d'œuf, etc.
Exemple: Gélose au sang frais, gélose au sang cuit.
3. Milieu sélectif et milieu d'enrichissement
Un milieu sélectif est formulé pour inhiber la croissance de certaines espèces bactériennes.
Ces milieux peuvent être formulés en ajoutant des réactifs sélectifs supplémentaires, tels qu'une concentration saline élevée pour sélectionner les halophiles,
éosine-bleu de méthylène toxique pour les bactéries Gram-positives.
Exemple: Gélose EMB, gélose MacConkey.
Un milieu d'enrichissement permet également la croissance d'espèces bactériennes spécifiques, cependant,
les milieux d'enrichissement sont complétés par un réactif qui permet, plutôt qu'il n'inhibe, la croissance d'une espèce particulière.
Exemple: Bouillon Sélénite F (sélénite est un inhibiteur pour les coliformes et bénéfique pour la récupération des espèces de Salmonella), gélose Thayer Martin.
4. Milieu différentiel
Le milieu de culture dit « différentiel » ou « indicateur »
permet de distinguer deux types de microorganismes se développant dans un même milieu. Ce type de milieu utilise les caractéristiques biochimiques d'un micro-organisme se développant en présence de nutriments et/ou d'indicateurs spécifiques (tels que le rouge neutre ou le bleu de méthylène) ajoutés au milieu pour indiquer visiblement les caractéristiques déterminantes d'un micro-organisme.
Exemple: Gélose MacConkey (Par la fermentation du lactose), gélose chapman (par la fermentation du mannitol).
5. Milieu de transport
Ces milieux sont utilisés lorsque les spécimens ne peuvent pas être cultivés peu de temps après le prélèvement. Les milieux de transport empêchent le dessèchement de l'échantillon et inhibent la prolifération de bactéries indésirables.
Exemple: Gélose Cary-Blair, écouvillons de transport gélosés amiès.
6. Milieu anaérobie
Les bactéries anaérobies ont besoin d'un potentiel d'oxydo-réduction réduit et de nutriments supplémentaires. De tels milieux peuvent être réduits par des moyens physiques ou chimiques.
Exemple: La gélose anaérobie Schaedler, gélose Wilkins-Chalgren.
◉ Classification des milieux de culture selon la méthode de préparation
1. Milieu prêt à l'emploi
Milieu de culture prêt à l'emploi est un milieu solide ou liquide fourni en boites, flacons, tubes ou autres récipients, sous forme prête à l'emploi ou prête à l'emploi après refusion et supplémentation.
2. Milieu préparé à partir de formulations déshydratées
Un milieu de culture est un milieu sous forme sèche qui nécessite une réhydratation et un traitement avant utilisation, aboutissant soit à un milieu complet, soit à un milieu incomplet auquel des suppléments sont ajoutés avant utilisation.
◉ Gélose nutritive ordinaire
Relativement simplifiée, la formulation apporte les éléments nutritifs nécessaires à la croissance d’une grande variété de germes non exigeants,Il est recommandé par l’American Health Association pour la numération des bactéries dans les eaux.
La gélose nutritive est dépourvu d'indicateur, d'agent sélectif, d'ingrédients différentiels et de substances enrichissantes, donc utilise pour une meilleure expression de la pigmentation, test biochimique et même pour le sérotypage.
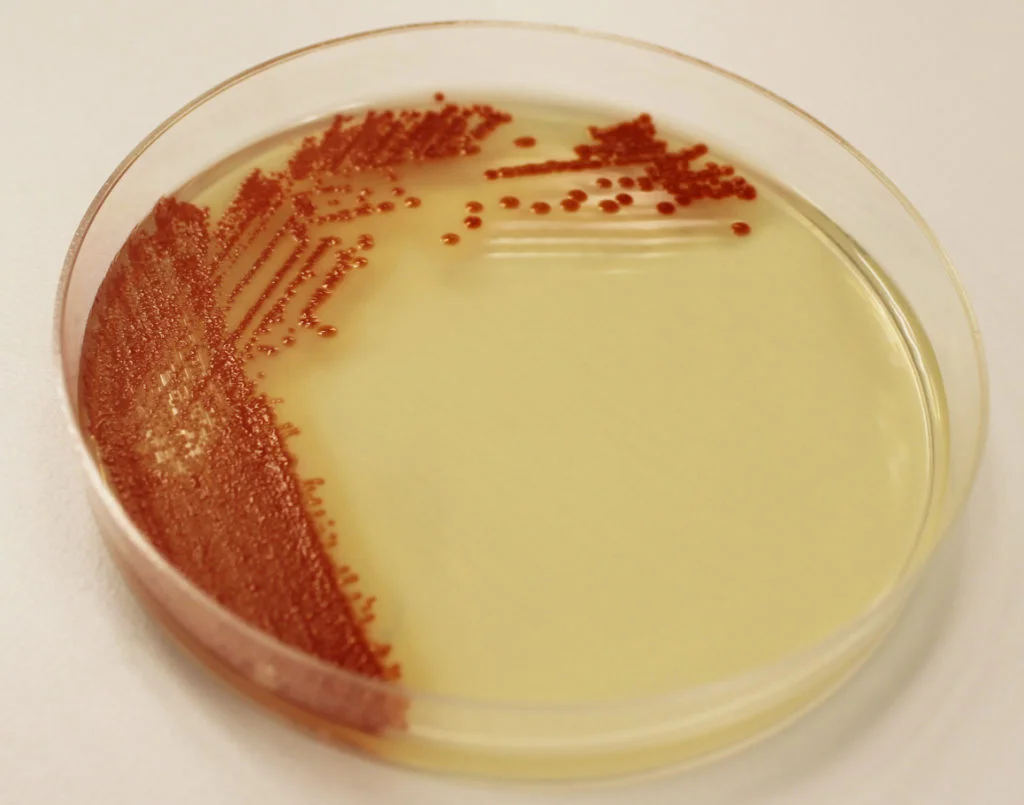
Serratia sur gélose nutritive
● Pour plus de détails sur la Gélose nutritive.
◉ Gélose Mueller Hinton
La gélose Mueller–Hinton est un milieu solide standardisé recommandé pour l’étude de la sensibilité des bactéries aux agents antimicrobiens par la méthode de diffusion ou de dilution en gélose.
La standardisation du milieu de Mueller-Hinton est nécessaire pour obtenir des résultats fiables au niveau de l'antibiogramme. Celle-ci concerne la composition du milieu avec des concentrations limites de CaCl 2+, MgCl2+ et ZnCl2+.
Elle peut également être additionnée de sang pour réaliser l'antibiogramme des germes fragiles, tels que Haemophilus influenzae, Neisseria et Streptococcus pneumoniae
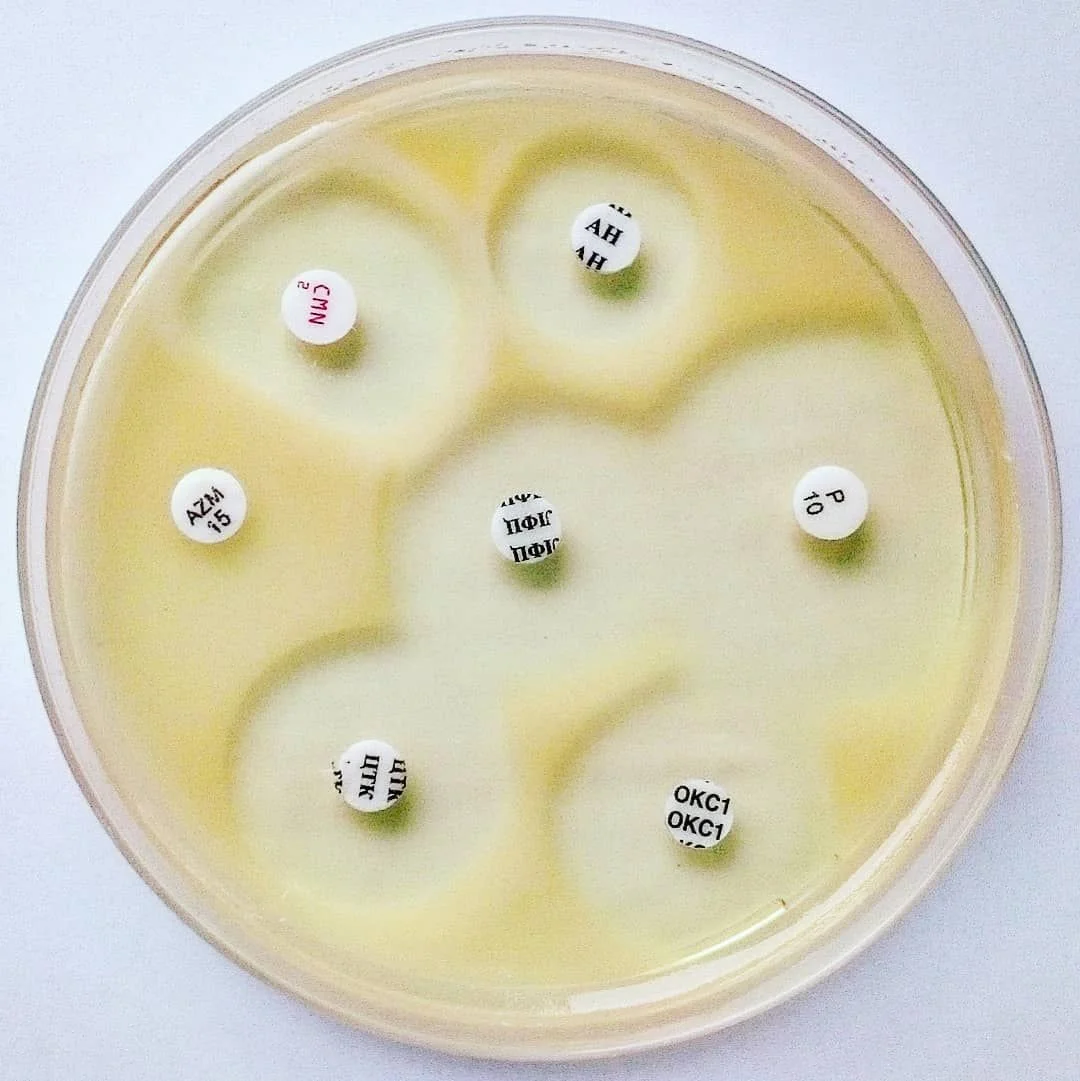
Gélose Mueller-Hinton
● Pour plus de détails Gélose Mueller Hinton.
◉ Bouillon nutritif
Le Bouillon Nutritif est un milieu largement utilisé pour la culture des micro-organismes peu exigeants. Il est recommandée dans de nombreuses méthodes standardisées d’analyses des aliments, des laitages, de l’eau et d’autres produits.
Le Bouillon Nutritif est constitué d’un mélange de Tryptone et d'extrait de viande qui contribue à la croissance des microorganismes. Le chlorure de sodium est destiné au maintien de la pression osmotique.

Bouillon nutritif
● Pour plus de détails sur Bouillon nutritif.
◉ Gélose Cled
En 1960, Sandys a étudié un moyen permettant d’éviter l’envahissement des boîtes par les Proteus, en utilisant un milieu déficient en électrolytes. La gélose CLED (Cystine Lactose Electrolyte Deficient) est utilisée pour l’isolement, la numération et la différenciation des microorganismes urinaires
La fermentation du lactose en acide est mise en évidence par le virage du vert au jaune de l’indicateur de pH, le bleu de bromothymol. La cystine favorise la croissance des coliformes donnant habituellement de petites colonies sur d’autres milieux. La déficience en électrolytes réduit l’envahissement du milieu par les Proteus.
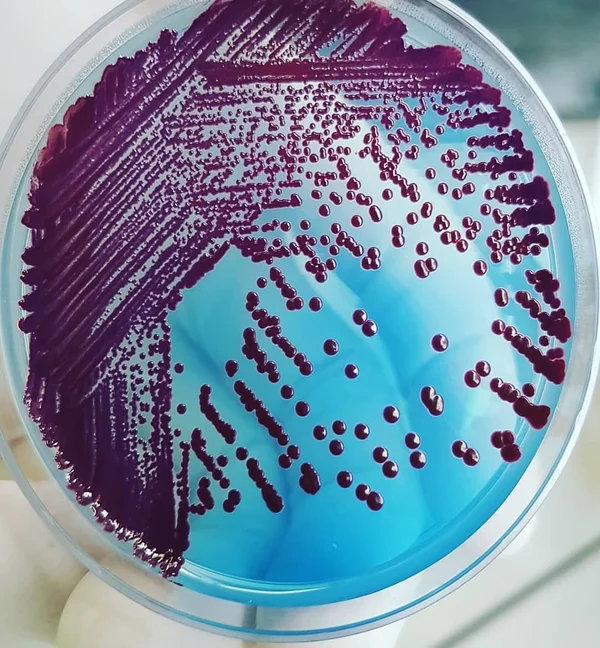
Serratia sur Cled
● Pour plus de détails sur La gélose CLED.
◉ Gélose Columbia
La gélose Columbia est un milieu très nutritif permettant la culture et l’isolement d’une grande variété de microorganismes et plus particulièrement des germes très exigeants (tels que streptocoques et pneumocoques). Par addition de sang, d’agents sélectifs ou d’accélérateurs de croissance, il est possible de préparer une grande diversité de milieux adaptés à des utilisations spécifiques.

Gélose Columbia
● Pour plus de détails sur Gélose Columbia.
◉ Milieu Chapman
Les staphylocoques pathogènes forment des colonies luxuriantes, pigmentées, entourées d’une auréole jaune due à la fermentation du mannitol. Les staphylocoques non pathogènes forment en général de petites colonies rouges qui ne modifient pas la teinte du milieu.
Quelques souches de Staphylococcus epidermidis sont capables de fermenter le mannitol.
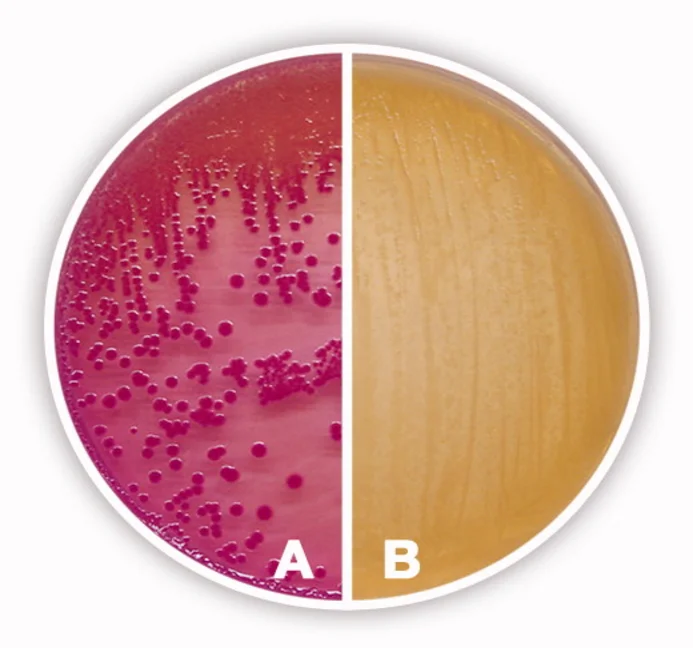
Gélose Chapman
● Pour plus de détails sur Gélose Chapman.
◉ Milieu Hektoen
La gélose Hektoen est un milieu sélectif pour l'isolement et la différenciation des bacilles Gram (-) entéropathogènes, en particulier les Salmonelles sp. et les Shigella sp.
La sélectivité de ce milieu est basée sur la présence de sels biliaires, de bleu de bromothymol et de fuchsine acide. La différenciation est basée sur leur capacité à fermenter différents sucres : le lactose, le saccharose, la salicine.
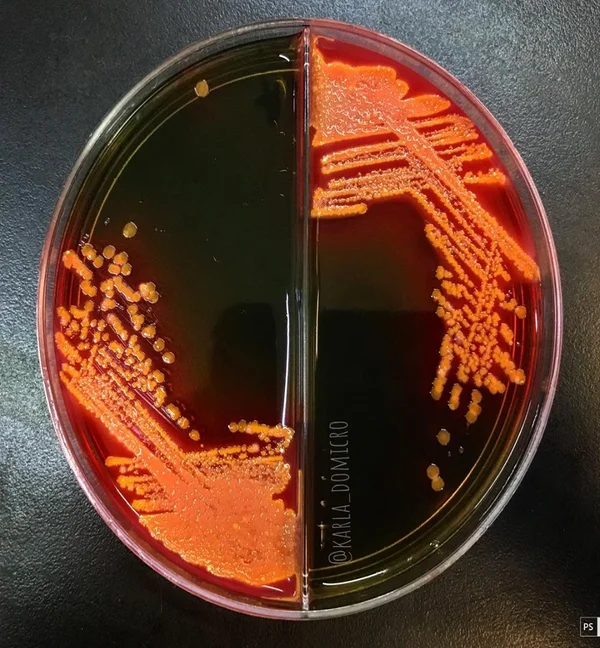
Gélose Hektoen
● Pour plus de détails sur Gélose Hektoen.
◉ Gélose TSI
La gélose TSI est utilisée pour l’identification présomptive des entérobactéries basée sur la fermentation du glucose, du lactose, du saccharose et sur la production de gaz et d’H2S.
- La Triple Sugar Iron Agar contient trois glucides ( glucose, lactose et saccharose ). La fermentation de ces glucides provoque une production d'acide, qui est détectée par l'indicateur au rouge de phénol. Des changements de couleurs en résultent, et le milieu vire au jaune en cas de production d'acide, ou au rouge en cas d'alcalinisation.

Gélose TSI
● Pour plus de détails sur Gélose TSI.
◉ Identification par microméthode "API"
Les galeries Api utilisent plusieurs types de tests : étude de la fermentation de divers glucides, auxanogramme, recherche directe d'une enzyme.
Chaque tubule contient un substrat différent sur lequel le micro-organisme considéré va réagir. Ils sont remplis d'une suspension bactérienne calibrée (de densité différente selon la galerie).
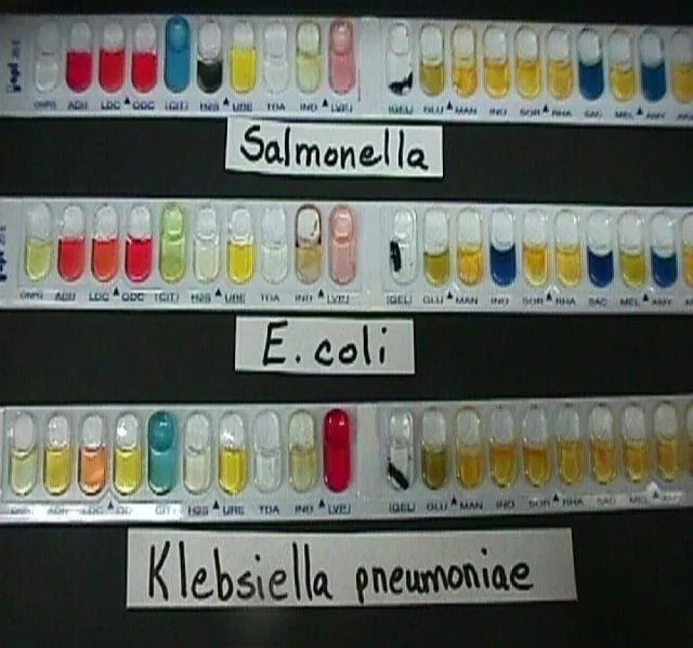
Galeries Api.
● Pour plus de détails sur galeries Api.