Contenu :
Gélose de Chapman | Composition | Lecture
◉ Généralités
La gélose Chapman ou gélose au sel de mannitol est un milieu sélectif utilisé pour l'isolement, le dénombrement et la différenciation des Staphylococcus à partir d'échantillons cliniques, alimentaires, antiseptiques et cosmétiques.
Ce milieu est à la fois une gélose sélectif et différentielle. Le milieu sélectionnera des organismes qui peuvent vivre dans des zones à forte concentration en sel (chlorure de sodium) et la fermentation du mannitol, mise en évidence par le virage au jaune de l’indicateur pH (rouge de phénol), permet d’orienter le diagnostic.

Gélose de Chapman (@lablife)
◉ Principe
◈ La sélectivité de ce milieu est basée sur la présence de chlorure de sodium (7.5%) qui inhibe la plupart des bactéries à Gram négatif et à Gram positif.
◈ La différenciation est basée sur la capacité à fermenter ou non le mannitol (le seul sucre du milieu). S'il y a fermentation, cela induit une acidification qui entraîne, à des niveaux de pH inférieurs à 6.9, une coloration jaune du milieu en présence de rouge de phénol (indicateur de pH).
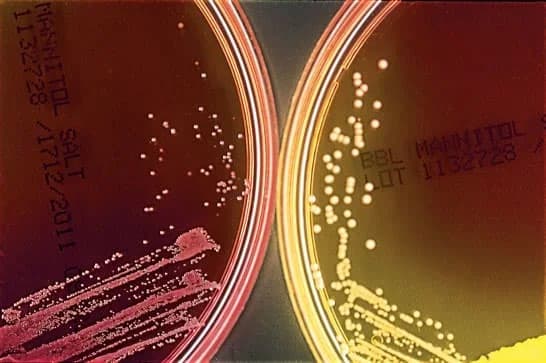
S. coagulase négative (à gauche) et S. aureus (à droite) ont été inoculés sur la gélose puis ont été incubés pendant la nuit.(8)
NB :
- Dans les échantillons cliniques, les isolats positifs au mannitol sont évocateurs de Staphylococcus aureus et devraient faire l’objet de tests plus poussés.
- Une bactérie non fermentante qui résiste à la concentration élevée en sel donne une zone rouge à rose en raison de la dégradation de la peptone
◉ Préparation / Composition gélose Chapman
☰ Pour 1 litre de milieu :
Composition gélose Chapman |
|||
|---|---|---|---|
| Ingrédients | gramme/litre | ||
| Peptone | 10 g | ||
| Extrait de viande de boeuf | 1 g | ||
| Chlorure de sodium | 75g | ||
| Mannitol | 10g | ||
| Rouge de phénol | 0,025g | ||
| Agar | 15g | ||
| pH final | 7,4 ± 0,2 | ||

Gélose Chapman déshydraté
Préparation milieu déshydraté
Mettre 111 grammes de milieu déshydraté dans un litre d’eau distillée stérile. Mélanger jusqu’à obtention d’une suspension homogène. Chauffer lentement en agitant fréquemment, puis porter à ébullition jusqu’à dissolution complète. Stériliser à l’autoclave à 121° C pendant 15 minutes. Répartir en boîtes de Petri ou en flacons.
Milieu Préparé
Faire fondre le contenu du flacon au bain-marie à 100°C (en desserrant le bouchon partiellement retiré) jusqu'à dissolution complète. Revisser ensuite le bouchon et vérifier l'homogénéité du milieu dissous, si c'est le cas en retournant le flacon. Refroidir à 45-50°C, bien mélanger en évitant la formation de mousse et répartir aseptiquement dans des boîtes de Pétri.

Gélose Chapman Préparé
◉ Interpretation
Les staphylocoques aureus forment des colonies luxuriantes, pigmentées, entourées d’une auréole jaune due à la fermentation du mannitol. Les staphylocoques non pathogènes forment en général de petites colonies rouges qui ne modifient pas la teinte du milieu.
Note : Le changement de couleur du milieu démontre la fermentation du mannitol, PAS la couleur de la colonie. Ceci est particulièrement important car de nombreux microcoques sont pigmentés.
Plusieurs espèces de Staphylococcus autres que S. aureus sont positives au mannitol et produisent des colonies de couleur jaune entourées de zones jaunes (ex: S. capitis, S. xylosus, S. cohnii, S. sciuri, S. simulans..). Par conséquent, des tests biochimiques supplémentaires sont nécessaires à l’identification de S. aureus ou d’autres espèces.
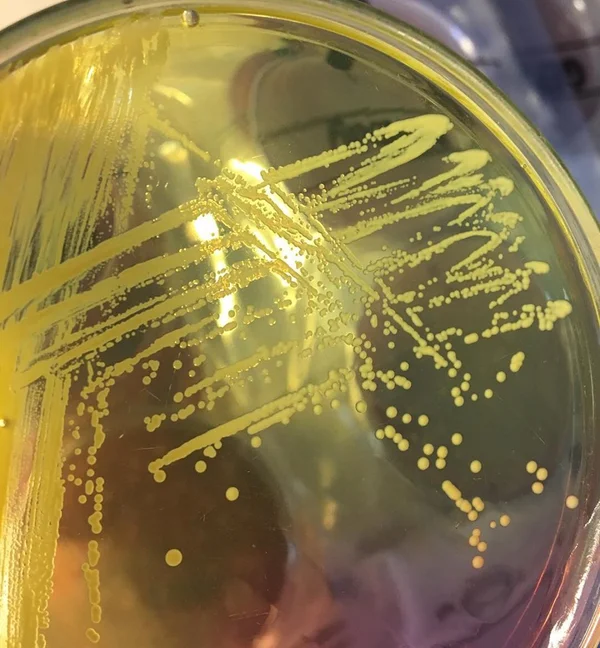
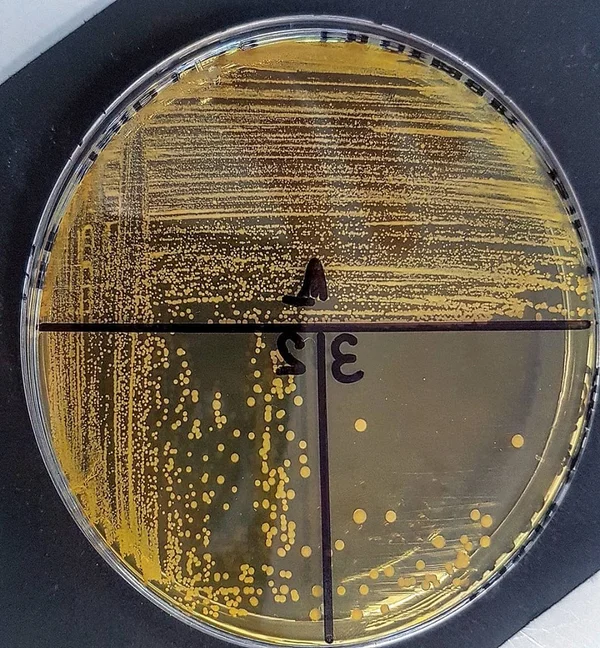
Chapman avec oxacilline peut être utilisé pour dépister la présence de SARM dans les échantillons nasaux, car le sel à 7,5% et 6 g d'oxacilline dans ce milieu inhibent la plupart des autres organismes qui colonisent normalement les narines.
L'ajout de 5% v/v d'émulsion de jaune d'œuf permet la détection de l'activité lipase des staphylocoques ainsi que la fermentation du mannitol. Le sel nettoie l'émulsion de jaune d'œuf et la production de lipase est détectée sous la forme d'une zone opaque jaune autour des colonies.
NB :- D'autres genres tels que Micrococcus elutes et Micrococcus roses produisent respectivement des colonies jaunes et roses
- Enterococcus faecalis et Enterococcus faceium sont également tolérants au sel et peuvent fermenter le mannitol en produisant des colonies jaunes sur la gélose
- les streptocoques du groupe D peuvent se développer sur ce milieu et présenter une légère fermentation du mannitol. Cependant les colonies sont petites et peuvent facilement être différenciées des staphylocoques par coloration de Gram ou par le test de la catalase.
- Les boites inoculées qui sont conservées au réfrigérateur peuvent présenter une perte de couleur au fil du temps