Test indole : Principe, procédure, résultats et interprétation
Sommaire :
Introduction
Dès 1889, l'indole test a été utilisé comme moyen de distinguer entre Escherichia
coli et Enterobacter aerogenes ,
le test recherche la capacité d'un organisme à dégrader le tryptophane et produire de
l'indole,
La production d'indole est mise en évidence par l'addition de réactif de Kovac qui agit avec l'indole en donnant une coloration rouge
Principe du test de l'indole
Le test d'indole détermine la capacité d'un organisme à produire de l'indole à
partir de la dégradation de l'acide aminé tryptophane.
Le tryptophane est hydrolysé par la tryptophanase pour produire trois produits possibles :
l'indole, pyruvate et l'ion ammonium :
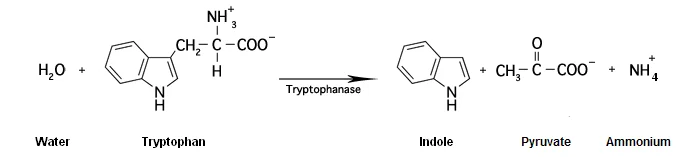
Réaction du test d'indole
La détection de l'indole repose sur la réaction chimique entre l'indole et le réactif de Kovac
(alcool isoamylique, para-Diméthylaminobenzaldéhyde, acide chlorhydrique concentré) dans des
conditions acides :
- Le para-Diméthylaminobenzaldéhyde réagit avec l'indole présent dans le milieu pour former un
colorant rouge rosindole.
- L'alcool isoamylique forme un complexe avec le colorant "rosindole", ce qui provoque sa
précipitation.
- L'alcool restant et le précipité remontent alors à la surface du milieu.
Procédure et résultats
◍ Deux méthodes sont décrites :
- Méthode en tube : la méthode conventionnelle qui identifie ,après une incubation d'une nuit, les
organismes producteurs d'indole faibles.
- Spot indole test : détecte les organismes producteurs rapide d'indole
1- Méthode conventionnelle en tube
La principale exigence de milieu pour un test d'indole approprié est qu'il contienne une quantité
suffisante de tryptophane (Bouillon tryptone, milieu eau peptonée exempte d'indole, milieu
Urée-indole,
bouillon tryptophane peptoné, milieu de motilité sulfure-indole (SIM)...).
- Inoculer le bouillon tryptophane (ou peptone) avec l'organisme à tester et incuber à 37°C
pendant 24 à 48h
- Ajouter 0,5 ml (5 gouttes) de réactif de Kovác et agiter doucement
- Examiner la couche supérieure de liquide après environ 1 min
◉ Résultat : Un résultat positif est indiqué par la présence d'une couleur rouge ou rouge-violet dans
la couche d'alcool de surface du bouillon.
Un résultat négatif apparaît en jaune. Un résultat variable peut également se
produire, affichant une couleur orange en conséquence.
Cela est dû à la présence de skatole, également connu sous le nom de méthyl indole ou indole
méthylé, un autre produit possible de dégradation du tryptophane.

Test d'indile Positif et Négatif
2- Spot test
- Placer plusieurs gouttes (1 -1,5 ml) de réactif Indole Spot (1% or 5% p-methylaminobenzaldehyde
ou 1% p-dimethylaminocinnamaledhyde) sur un morceau de papier filtre.
- Etaler une colonie pure isolée (à partir d'une culture de 18 à 24 heures) sur la surface saturée
du papier filtre à l'aide d'une boucle stérile
- Examiner immédiatement

Indole Spot test
◉ Résultat : Selon le réactif utilisé pour le test spot indole, les couleurs résultantes
diffèrent. Si vous utilisez du p-méthylaminobenzaldéhyde, la présence d'indole est indiquée par
une couleur rouge
et si vous utilisez du p-diméthylaminocinnamaledhyde, une couleur bleu-vert est observée.
Test d'indole positif et négatif
◍ Bactéries indole positif et négatif (9, 10, 11) |
| Bactéries |
Indole positif |
Indole variable |
Indole négatif |
| Escherichia spp. |
Escherichia coli , Escherichia fergusonii |
/ |
Escherichia albertii |
| Shigella spp. |
/ |
Shigella boydii , Shigella dysenteriae , Shigella flexneri |
Shigella sonnei |
| Salmonella spp. |
/ |
/ |
Salmonella spp. |
| Klebsiella spp. |
K. oxytoca |
/ |
Klebsiella pneumoniae |
| Raoultella spp. |
R. ornithinolytica |
R. planticola |
R. terrigena |
| Serratia spp. |
/ |
S. odorifera biogroup 1, S. odorifera biogroup 2 |
S. entomophila, S. ficaria, S. fonticola, S. liquefaciens group, Serratia marcescens, S. plymuthica, S. rubidaea |
| Citrobacter spp. |
C. amalonaticus, C. farmeri, C. koseri, C. murliniae, |
C. braakii ,C. freundii , C. sedlakii, C. youngae |
C. gillenii , C. werkmanii |
| Edwardsiella tarda |
Edwardsiella tarda |
/ |
/ |
| Proteus |
P. hauseri , P. vulgaris |
/ |
Proteus mirabilis , P. penneri |
| Providencia |
P. stuartii , P. rettgeri , P. rustigianii , P. alcalifaciens |
/ |
P. heimbachae |
| Morganella |
M. morganii |
/ |
/ |
| Yersinia spp. |
/ |
Y. enterocolitica |
Y. pestis , Y. pseudotuberculosis |
| Bacilles à Gram négatif non fermentaire |
Elizabethkingia ,Chryseobacterium , Balneatrix, Bergeyella, Empedobacter, Wautersiella, Weeksella |
/ |
Acinetobacter , Moraxella, Paracoccus, Sphingobacterium, Shewanella, Rhizobium, Ochrobactrum, Psychrobacter, Sphingomonas, Pseudochrobactrum |
| Actinobacillus spp |
/ |
/ |
A. lignieresii, A. equuli , A. suis, A. ureae, A. hominis |
| Actinobacillus spp |
/ |
/ |
A. lignieresii, A. equuli , A. suis, A. ureae, A. hominis |
| Aggregatibacter spp |
/ |
/ |
A. actinomycetemcomitans , A. aphrophilus, A. segnis |
| Capnocytophaga spp |
/ |
/ |
C. ochracea , C. sputigena, C. gingivalis, C. granulosa, C. haemolytica, C. canimorsus, C. cynodegmi |
| Cardiobacterium spp |
C. hominis (faible) |
C. valvarum |
/ |
| Chromobacterium spp |
/ |
C. violaceum |
C. haemolyticum |
| Dysgonomonas spp |
D. hofstadii , D. mossii |
D. capnocytophagoides , D. gadei |
/ |
| Eikenella spp |
/ |
/ |
E. corrodens |
| Kingella spp |
/ |
/ |
K. kingae , K. denitrificans, K. negevensis, K. oralis , K. potus |
| Pasteurella spp |
P. multocida , P. canis , P. dagmatis , P. oralis , P. stomatis |
/ |
/ |
| Streptobacillus spp |
/ |
/ |
S. moniliformis |
| Suttonella spp |
S. indologenes |
/ |
/ |
| Haemophilus influenzae |
Biotype I II V VII |
/ |
Biotype III IV VI VIII |
| Actinomyces spp. |
/ |
/ |
Actinomyces spp. |
| Bacteroides spp. |
B. ovatus , B. thetaiotaomicron |
/ |
B. fragilis , B. vulgatus |
| Fusobacterium spp. |
F. necrophorum , F. nucleatum |
F. varium |
F. mortiferum |
| Clostridium spp. |
C. sordellii , |
C. tetani |
C. tertium , C. septicum, C. ramosum, C. perfringens, C. innocuum, Clostridium
botulinum |
Limites et conseils techniques
Le test en tube est plus sensible que le Spot test .
Le réactif d'Ehrlich est un alternatif au réactif de Kovács, Ehrlich est plus sensible alors que Kovács est plus stable
Les milieux contenant du glucose ne doivent pas être utilisés pour les tests d'indole en raison de la formation de produits finaux acides qui réduisent la production d'indole.
La gélose Mueller Hinton ne doit pas non plus être utilisée pour ce test car le tryptophane est détruit lors de l'hydrolyse acide de la caséine.
Si un bouillon de peptone est utilisé à la place du bouillon de tryptophane,
le lot doit être vérifié avec un contrôle positif. C'est parce qu'il existe des variétés de bouillons peptonés,
et certaines ne conviennent pas à la production d'indole car elles contiennent trop peu de tryptophane.
Les organismes à tester par la méthode spot indole doivent être prélevés dans un milieu
contenant du tryptophane (par exemple de la gélose au sang) et jamais dans de la gélose MacConkey car ils ont des indicateurs de pH
et une pigmentation de colonies lactose-positives qui rendront l'interprétation de la réaction colorée difficile.
L'indole est un produit diffusible. Pour atténuer la diffusion de l'indole, sélectionnez une colonie bien isolée pour le test spot de l'indole.


