Contenu:
Haemophilus Influenzae : Classification, Identification, Infection et Résistance
◉ Introduction
Haemophilus influenzae est une bactérie à Gram négatif qui a longtemps été un pathogène redoutable, en particulier chez les enfants. Bien qu'elle ait été initialement identifiée comme la cause présumée de la grippe (d'où son nom influenzae), elle est aujourd'hui reconnue comme un agent majeur d'infections respiratoires et invasives, telles que la méningite, la pneumonie et l'épiglottite. Grâce à la vaccination, l'incidence des infections à H. influenzae de type b (Hib) a considérablement diminué, mais les souches non typables (NTHi) restent une préoccupation majeure, notamment chez les adultes atteints de maladies pulmonaires chroniques ou immunodéprimés.
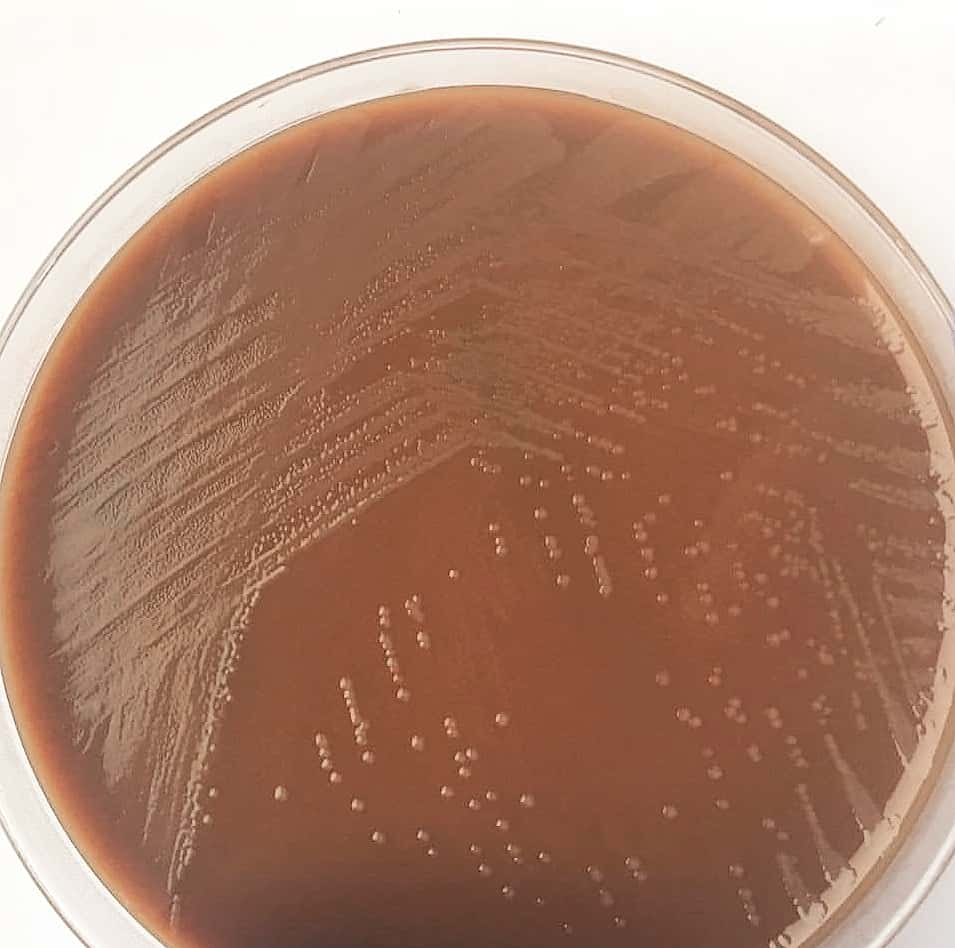
Photo 01: Culture de Haemophilus influenzae
◉ Origine du nom : Haemophilus influenzae
Le nom Haemophilus influenzae est riche en signification, reflétant à la fois ses propriétés biologiques et son histoire.
Haemophilus :
- Le terme "Haemophilus" vient du grec haema (sang) et philos (aimant), signifiant "qui aime le sang". Ce nom fait référence au besoin essentiel de la bactérie en facteurs de croissance présents dans le sang : le facteur X (hémine) et le facteur V (NAD ou NADP). Ces facteurs sont indispensables à sa croissance et à sa survie.
Influenzae :
- Le nom "influenzae" a été donné par Richard Pfeiffer en 1892, lorsqu'il a isolé la bactérie chez des patients atteints de grippe. À l'époque, on croyait à tort que cette bactérie était la cause de la grippe (en italien, influenza signifie "influence", en référence à l'influence supposée des astres sur cette maladie). Bien que cette hypothèse ait été réfutée, le nom est resté.
◉ Classification / Nomenclature
Haemophilus influenzae appartient au genre Haemophilus, qui comprend 16 espèces, au sein de la famille des Pasteurellaceae. H. influenzae est l'espèce type du genre et se distingue par son besoin de facteurs de croissance spécifiques.
- Famille : Pasteurellacées
- Genre : Haemophilus.
- Espèce type : H. influenzae.
Les souches de H. influenzae sont classées en deux catégories principales : les souches encapsulées (typables) et les souches non encapsulées (non typables, NTHi). Les souches encapsulées sont sérotypées en six groupes (a à f) en fonction de leur capsule de polyribitol phosphate.
◉ Épidémiologie
Haemophilus influenzae colonise normalement les voies respiratoires supérieures des humains. Avant l'introduction du vaccin conjugué, H. influenzae de type b (Hib) était la principale cause de méningite bactérienne chez les enfants de moins de 5 ans, avec un taux de portage de 2 à 4 %. Grâce à la vaccination, ce taux est aujourd'hui inférieur à 1 %. Cependant, les souches non typables (NTHi) colonisent 50 à 80 % de la population et sont responsables d'infections respiratoires récurrentes chez les adultes.
La transmission de H. influenzae se fait principalement par contact direct avec des sécrétions respiratoires. Les infections invasives, comme la méningite ou la septicémie, surviennent lorsque la bactérie traverse la muqueuse respiratoire et pénètre dans la circulation sanguine. Les souches encapsulées, en particulier le type b, sont capables de résister à la phagocytose grâce à leur capsule, ce qui leur permet de se disséminer vers d'autres organes.
◉ Pathogénèse
Haemophilus influenzae est un pathogène opportuniste qui provoque des infections en exploitant les faiblesses des défenses de l'hôte. Sa capacité à causer des maladies dépend de plusieurs facteurs de virulence, dont les plus importants sont sa capsule et ses adhésines.
- Capsule : Les souches encapsulées (typables) possèdent une capsule de polyribitol phosphate qui les protège de la phagocytose, permettant des infections invasives comme la méningite et la septicémie.respiratoires grâce à des protéines de surface (Hia, Hap), causant des infections localisées comme l'otite moyenne et la sinusite.
- Adhésines : Les souches non encapsulées (non typables, NTHi) adhèrent aux muqueuses respiratoires grâce à des protéines de surface (Hia, Hap), causant des infections localisées comme l'otite moyenne et la sinusite.
- Biofilms : La formation de biofilms protège la bactérie des défenses immunitaires et des antibiotiques, favorisant des infections chroniques.
- Évasion immunitaire : H. influenzae produit des protéases qui dégradent les IgA sécrétoires, neutralisant une partie de la réponse immunitaire locale.
◉ Maladies
Haemophilus influenzae était autrefois la principale cause de méningite chez les enfants, mais l'introduction du vaccin conjugué a réduit l'incidence de cette maladie de plus de 90 %. Aujourd'hui, H. influenzae reste une cause importante d'infections respiratoires, notamment :
- Chez les enfants : Otite moyenne, sinusite, conjonctivite, épiglottite.
- Chez les adultes : Pneumonie, exacerbations de BPCO, infections nosocomiales.
Les souches non typables (NTHi) sont particulièrement préoccupantes chez les adultes immunodéprimés ou atteints de maladies pulmonaires chroniques.
◉ Morphologie et identification
◉ A. Morphologie
- Dans les échantillons cliniques provenant d'infections aiguës, Haemophilus influenzae se présente sous forme de petits bacilles à Gram négatif (1,5 μm), souvent observés en paires ou en chaînes courtes
- En culture, sa morphologie varie en fonction du milieu et de la durée d'incubation:
- Après 6 à 8 heures dans un milieu riche, les formes cocco-bacillaires prédominent, tandis que des formes plus longues et pléomorphes apparaissent avec le temps.
- Les jeunes cultures (6 à 18 heures) présentent une capsule bien définie, essentielle pour le sérotypage et la virulence de la bactérie.
◉ B. Culture et croissance
- H. influenzae se développe sur gélose au chocolat enrichie en IsoVitaleX, formant des colonies plates, brun grisâtre, d'un diamètre de 1 à 2 mm après 24 heures d'incubation.
- La croissance nécessite la présence de deux facteurs essentiels : le facteur X (hémine) et le facteur V (NAD).
- Sur gélose au sang de mouton, la bactérie peut se développer à proximité des colonies de staphylocoques, un phénomène appelé "phénomène satellite ", dû à la libération de NAD par les staphylocoques.
◉ C. Identification
L'identification de H. influenzae repose sur :
- Les besoins en facteurs X et V : Des tests spécifiques, comme la croissance satellite ou l'utilisation de bandelettes contenant ces facteurs, permettent de confirmer ces besoins.
- Le sérotypage : Basé sur les polysaccharides capsulaires, il distingue les souches typables (a à f) des souches non typables (NTHi).
- Le biotypage : Les souches peuvent être classées en huit biotypes selon leur production d'indole, d'ornithine décarboxylase et d'uréase. Les biotypes I et II sont les plus fréquemment associés aux infections invasives.
◉ Tests de diagnostic en laboratoire
Le diagnostic de Haemophilus influenzae repose sur plusieurs méthodes, adaptées au type d'infection et aux échantillons disponibles (LCR, pus, sang..) :
- Coloration de Gram : Observation de petits bacilles à Gram négatif dans les échantillons cliniques (expectorations, liquide céphalo-rachidien, sang).
- Culture : Isolement sur gélose au chocolat enrichie en IsoVitaleX. Les colonies apparaissent plates, brun grisâtre, après 24 heures d'incubation. Le "phénomène satellite" sur gélose au sang de mouton confirme le besoin en facteur V.
- Tests biochimiques : Identification des besoins en facteurs X (hémine) et V (NAD) pour confirmer le genre Haemophilus.
- Techniques moléculaires : La PCR en temps réel permet de détecter rapidement H. influenzae et ses gènes de résistance aux antibiotiques (par exemple, blaTEM pour les bêta-lactamases).
- Détection d'antigènes : Les tests immunologiques pour détecter les antigènes capsulaires dans le liquide céphalo-rachidien sont moins utilisés en raison de leur faible sensibilité.

Technique: Lorsqu'il est cultivé sur de la gélose Mueller-Hinton, qui ne contient pas de facteur X ou V, H. influenzae ne se développe qu'entre les bandes imprégnées de facteurs X et V. Les facteurs diffusent dans le milieu, et des colonies sont observées dans les zones où la concentration de chaque facteur est propice à la croissance.
◉ Sensibilité aux antibiotiques
Haemophilus influenzae présente une résistance aux antibiotiques qui peut être intrinsèque ou acquise, nécessitant des tests de sensibilité pour guider le traitement.
◉ 1- Résistance intrinsèque
- Antibiotiques inefficaces : Macrolides à 16 atomes, lincosamides, glycopeptides.
- Sensibilité modérée : Macrolides à 14-15 atomes (érythromycine), céphalosporines de première génération.
◉ 2- Résistance acquise
- Bêta-lactamines : La résistance est souvent due à la production de bêta-lactamases (type TEM) ou à des mutations dans les protéines liant la pénicilline (PBP). Les inhibiteurs de bêta-lactamases (comme l'acide clavulanique) restaurent l'efficacité des antibiotiques.
- Autres antibiotiques : Résistance rare mais possible aux tétracyclines, fluoroquinolones et triméthoprime-sulfaméthoxazole.
Note : Des précautions doivent être prises lors de la préparation des concentrations d'inoculum (0,5 McFarland) pour Haemophilus spp. ; en particulier, les souches productrices de bêtalactamase de H. influenzae, car des suspensions plus élevées peuvent conduire à des résultats faussement résistants.
◉ Conclusion
Haemophilus influenzae reste un pathogène important, malgré les progrès de la vaccination. Les souches non typables (NTHi) et la résistance aux antibiotiques représentent des défis majeurs pour la santé publique. Des efforts sont nécessaires pour développer de nouveaux vaccins ciblant les souches non typables et pour surveiller l'émergence de la résistance aux antibiotiques. Une meilleure compréhension des mécanismes de virulence et de résistance ouvrira la voie à de nouvelles stratégies thérapeutiques.