Contenu :
Bandelettes de CMI | Etest | Principe | Lecture
◉ Introduction
Les bandelettes CMI permettent la détermination quantitative des concentrations inhibitrices minimales (CMI) des antibiotiques / antifongiques vis à vis des bactéries /champignons ainsi que la détection des mécanismes de résistance.
Les bandelettes CMI sont des bandes de papier spécifiques imprégnées de gradients prédéfinis de concentration antibiotique (couvrant 15 doubles dilutions comme pour les méthodes de CMI conventionnelles ).
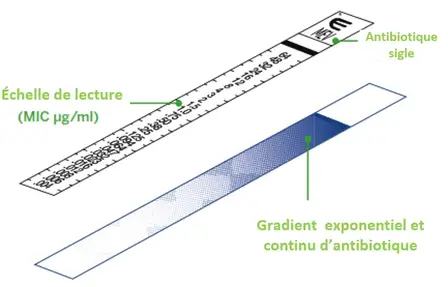
◉ Principe
C’est est une bandelette en plastique mince, inerte et non poreuse avec une échelle de lecture de la CMI en g/mL d'un côté, et de l'autre côté, un gradient d'antibiotique prédéfini.
Lorsqu'il est appliqué sur une surface de gélose ensemencée, le gradient d'antibiotique préformé se transfère immédiatement dans la gélose pour former un gradient stable, continu et exponentiel de concentrations d'antibiotiques sous la bandelette.
Exemple:
- Etest® : développé par AB Biodisk, Solna, Suède, et actuellement commercialisé par BioMérieux, Italie ,
- MIC Test Strip® : développé par LIOFILCHEM, Italie
◉ Procédure
❶ Suspendre les colonies bien isolées d'une boite de gélose pour obtenir une turbidité de 0,5 McFarland (une croissance confluente ou presque confluente doit être obtenue après incubation).
❷ Tremper un écouvillon stérile dans la suspension de l’inoculum et le presser sur la paroi du tube à essai pour éliminer l’excès de liquide.
❸ Laissez l’excès d’humidité être absorbé de sorte que la surface soit complètement sèche (15 – 20 minutes) avant d’appliquer les bandelettes CMI
❹ Appliquer la bandelette sur la surface de la gélose avec l'échelle vers le haut et le code de la bandelette vers l'extérieur de la plaque, en la pressant avec une pince stérile sur la surface de la gélose et s'assurer que toute la longueur du gradient antibiotique est en contact complet avec la surface de la gélose. Une fois appliqué, ne déplacez pas la bande.
❺ Si des bulles d'air sont emprisonnées sous la bandelette, déplacez-les doucement vers le bord à l'aide d'une pince stérile, en prenant soin de ne pas déplacer la bandelette sur la gélose. Lors de l'élimination des bulles d'air, commencez à la concentration la plus faible et augmentez.
❻ Incuber les plaques de gélose en position inversée à 35 ± 2°C .
❼ Après 18 heures d'incubation ou plus, une ellipse d'inhibition symétrique centrée le long de la bande est formée. La CMI est lue directement sur l'échelle en g/mL au point où le bord de l'ellipse d'inhibition coupe la bandelette de test CMI.
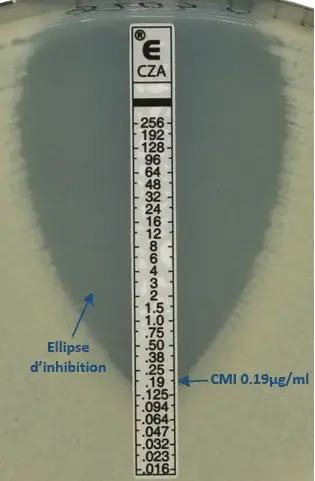
◉ Lecture Etest®
Après 18 heures d'incubation ou plus, une ellipse d'inhibition symétrique centrée le long de la bande est formée. La CMI est lue directement sur l'échelle en g/mL au point où le bord de l'ellipse d'inhibition coupe la bandelette de test CMI.








