🏾 Sommaire :
◉ Définition
L'acide trifluoroacétique (TFA) est un composé organofluoré (contient une liaison carbone-fluor) de formule chimique CF3CO2H. C'est un acide carboxylique fort en raison de la présence de trois atomes de fluor, fortement électronégatifs. Comparé à l'acide acétique, l'acide trifluoroacétique est environ 100 000 fois plus puissant.
L'acide trifluoroacétique a été découvert par Swarts en 1922, et est largement utilisé en synthèse organique comme solvant ou comme catalyseur acide pour différentes transformations organiques.
Le TFA, découvert au début du XXe siècle, est préparé industriellement par l'électrofluoration du chlorure d'acétyle ou de l'anhydride acétique, suivie de l'hydrolyse du fluorure de trifluoroacétyle résultant.
TFA |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Numéro CAS | 76-05-1 | ||||||||
| Masse moléculaire | 114.0233 g/Mol | ||||||||
| Formule | C2HF3O2 | ||||||||
| PKa | 0,3 | ||||||||
| Synonymes | Perfluoroacetic acid, Trifluoracetic acid, Trifluoroethanoic acid | ||||||||
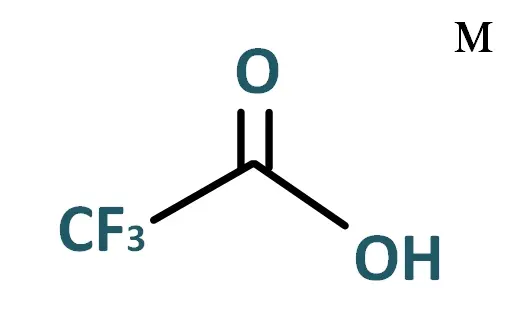
TFA : C2HF3O2
◉ Applications et utilisations de l'acide trifluoroacétique
L'acide trifluoroacétique est principalement destiné à la production de nouveaux pesticides, médicaments et colorants, et a également un grand potentiel d'application et de développement dans les domaines des matériaux et des solvants.
De nombreuses transformations chimiques doivent être effectuées à l'aide de TFA, notamment des réarrangements, des déprotections de groupes fonctionnels, des oxydations, des réductions, des condensations, des hydroarylations et des trifluorométhylations.
◉ Solvant
- La constante diélectrique élevée, la miscibilité avec l'eau et la plupart des solvants organiques du TFA ont permis son utilisation, seule ou en mélange, comme solvant à différentes fins. En tant que solvant, l'acide trifluoroacétique est une sorte d'excellent solvant pour la fluoration, la nitration et les halogénations.
- Comparé à l'eau comme solvant, l'acide trifluoroacétique a une meilleure solubilité pour les substrats organiques.
- Par exemple, lorsque la quinolone est catalysée pour l'hydrogénation dans un solvant commun, le cycle pyridine est préférentiellement hydrogéné; au contraire, le cycle benzénique sera préférentiellement hydrogéné en présence d'acide trifluoroacétique comme solvant.
◉ En chromatographie
- À faible concentration, le TFA est utilisé comme agent d'appariement d'ions en chromatographie liquide de composés organiques, en particulier de peptides et de petites protéines.
- Le TFA est souvent utilisé dans les laboratoires de purification à haut débit pour contrôler la forme des pics des composés basiques en s'assurant que les silanols résiduels omniprésents dans les colonnes C18 à base de silice sont dans leur état de charge neutre
◉ Réarrangements
- Lors de certaines réactions Il y a un potentiel pour que des changements structurels profonds se produisent. Un grand nombre de ces réarrangements structurels sont déclenchés par des intermédiaires impliquant des atomes chargés positivement ou déficients en électrons.
- Le TFA est un catalyseur courant pour la plupart des réarrangements acide-catalyseur, ayant l'avantage d'une élimination facile par évaporation pendant le traitement en raison de son bas point d'ébullition.
◉ Eliminnation des groupes protecteurs
- Le TFA est couramment utilisé comme acide fort pour éliminer les groupes protecteurs de chaîne latérale dérivés du t-butyle dans la synthèse des peptides Fmoc et dans d'autres synthèses organiques pour éliminer le groupe protecteur t-butoxycarbonyle.
- Il a été utilisé aussi comme réactif de choix pour l'élimination des groupes protecteurs d'azote et d'oxygène par solvolyse dans des conditions aqueuses ou anhydres.
◉ Propriétés
C'est un liquide fumant incolore et volatil avec une odeur similaire à celle de l'acide acétique. Il est hygroscopique et a une odeur stimulante. Il est miscible avec l'eau, les alcanes fluorés, le méthanol, le benzène, l'éther, le tétrachlorure de carbone et l'hexane. Il peut partiellement dissoudre un alcane avec plus de six carbones ainsi que du disulfure de carbone.
Le TFA est un acide plus fort que l'acide acétique, ayant une constante d'ionisation acide, Ka, qui est environ 34 000 fois plus élevée, car les atomes de fluor hautement électronégatifs et la nature attractrice d'électrons qui en résulte du groupe trifluorométhyle affaiblissent la liaison oxygène-hydrogène (permettant une plus grande acidité) et stabilise la base conjuguée anionique.
Il est stable à une température supérieure à 205 ℃ stable. Mais ses dérivés esters et amides sont facilement sujets à l'hydrolyse, ce qui leur permet de préparer des glucides, des acides aminés et des dérivés peptidiques sous forme d'acide ou d'anhydride. Il se déshydrate facilement sous l'action du pentoxyde de phosphore et se transforme en anhydride trifluoroacétique.
Il est courant d'éliminer l'excès de TFA par évaporation car d'autres méthodes d'élimination des réactifs sont souvent affectées par cet acide organique.