Contenu :
✑ Dr Hamzaoui.l
Ⅰ. Introduction
❍ La résistance bactérienne aux antibiotiques bêta-lactamines comprend la modification des porines (barrière de perméabilité) et des cibles (faible affinité des PBP pour le médicament), Efflux, production d'enzymes inactivantes (bêta-lactamases) et inhibition de la libération d'enzymes autolytiques. De plus, les bactéries ont développé des mécanismes génétiques sophistiqués pour s'adapter aux traitements avec de nouveaux antibiotiques bêta-lactamines.
Pour permettre un traitement antibiotique efficace de l’infection bactérienne à l’avenir, des connaissances sur les mécanismes de résistance aux antibiotiques sont nécessaires.
Ⅱ. Modification des PLP
❍ La résistance aux β-lactamines suite à une modification des PLP n'a été que rarement démontrée chez les entérobactéries. Elle peut résulter soit de:
- La perte d’affinité des PLP pour les β-lactamines par mutation ;
- L’acquisition de gènes ou fragments de gènes codant pour les PLP d’affinité diminuée ;
- L’hyperproduction de PLP normales.

Figure: Les β-lactamines traversent la membrane externe à travers les porines pour atteindre leurs cibles: les PBP (PLP) [A] La résistance survient suite à une modification de la cible [B]
Proteus mirabilis
Des souches résistantes à l’imipénème et au mécillinam ont été observées suite à:
- Une perte d’affinité de la PLP2
- Une diminution de la quantité de la PLP1A
⛔ Ce mécanisme de résistance rest très rare chez les entérobactéries
Ⅲ. Imperméabilité
❍ Les bactéries à Gram négatif possèdent à l’extérieur du peptidoglycane une structure supplémentaire, la membrane externe formée d’une couche interne de phospholipides et d’une couche externe de lipopolysaccharides
Sa nature hydrophobe empêche le passage des substances hydrophiles dont les βlactamines.
Les porines jouent un rôle important dans la pénétration transmembranaire des β- lactamines chez les bactéries à gram négatif.
Des résistances acquises par diminution de la perméabilité de la paroi on été rapportées suite à une altération quantitative ou qualitative des porines.
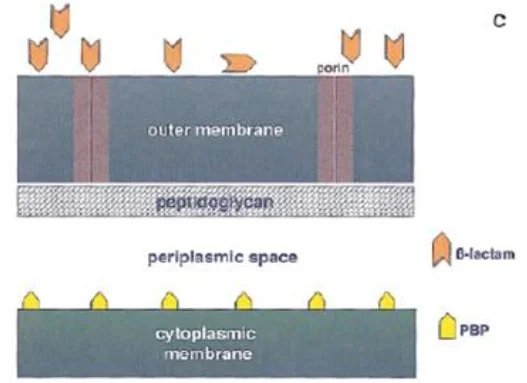
Figure: La résistance survient suite à une perte de la perméabilité
- OmpF et OmpC chez E.coli
- OmpK 36, OmpD et Omp36 chez K. pneumoniae, E. aerogenes, S. Thyphymurium
Ⅴ. Efflux actif
❍ Les systèmes d'efflux sont constitués chez les entérobactéries de trois protéines:
- Une insérée dans la membrane cytoplasmique, jouant le rôle de pompe
- Une seconde, insérée dans la membrane externe, assurant le passage au travers de la membrane externe,
- Une troisième, périplasmique qui formerait un lien entre la pompe et la porine.
Ces systèmes sont en fait des pompes assurant l'expulsion active des produits du métabolisme ou de toxiques, comme les antibiotiques.
En cas d'hyperexpression, ces systèmes, comme celui correspondant aux gènes marRAB chez E.coli, entraînent une résistance généralement à bas niveau et croisée à différentes familles d'antibiotiques comme les ß-lactamines, les quinolones, le chloramphenicol et les tétracyclines.
NB: La résistance par efflux est souvent couplée à une diminution de la perméabilité par diminution des porines. L'association de ces deux mécanismes peut entraîner une résistance à haut niveau et simultanée vis à-vis d'antibiotiques structuralement non reliés, constituant ainsi de véritables systèmes de multirésistance.
Ⅵ. Inactivation enzymatique
❍ Le mécanisme de résistance aux β-lactamines le plus répandu parmi les isolats cliniques de bactéries à Gram négatif est la production de β-lactamases
Les β -lactamases sont les enzymes d’inactivation les plus fréquemment rencontrées. Elles ont pour substrat une β-lactamine et hydrolysent le cycle β -lactame en clivant la liaison amide de l’antibiotique.
Elles agissent par l’intermédiaire d’un ester de sérine ou d’un mécanisme dépendant de l’ion zinc Zn 2

Figure: Schéma réactionnel de l’ouverture du cycle β-lactame.
Ces enzymes, dont le support génétique peut être chromosomique ou plasmidique, sont produites par les bactéries soit naturellement, soit au décours de l’acquisition de gènes de résistance. Leur expression peut être inductible ou constitutive.
Il s’agit de protéines de structure (poids moléculaire, composition en acides aminés, point isoélectrique, structure du site actif) et de propriétés catalytiques (spectre d’activité sur les différentes β-lactamines hydrolysées, sensibilité ou résistance aux inhibiteurs) très diverses.
☰ Il existe différentes classifications des β-lactamases :
☛ La classification structurale d’Ambler
Elle est fondée sur la séquence primaire en acides aminés d’éléments conservés du site actif. Elle divise ces enzymes d’inactivation en quatre groupes (A à D).
- Les enzymes des classes A, C et D sont dites à sérine active (type sérine),
- La classe B regroupe les métallo-β-lactamases (type métallo-enzymes), qui ont besoin d’ions Zn2+ .
☛ La classification structurale Bush
Reposant sur l’activité hydrolytique et la sensibilité des β- lactamases aux inhibiteurs.
◍ Les enzymes de classe A |
|---|
| ⚡ Pénicillinases à spectre restreint (groupe fonctionnel 2a) |
| ↦ Leur spectre d’hydrolyse se limite aux pénicillines ↦ Sensibles à l’acide clavulanique |
| ⚡ Pénicillinases à large spectre (groupe fonctionnel 2b) |
| ↦ Leur spectre est élargi aux C1G et, dans une moindre mesure, C2G (sauf céphamycines). ↦ Sensibles au clavulanate. Exemples : TEM (TEM-1 et TEM-2), SHV-1 |
| ⚡ BLSE (groupe fonctionnel 2be) |
| ↦ Leur spectre recouvre l’ensemble des β -lactamines à l’exception des carbapénèmes
et des céphamycines. (les activités des C4G et celles des associations β-lactamines/IBL sont variables). ↦ Selon la nature des mutations, ces enzymes confèrent une résistance CAZ > CTX (ex : TEM-5,TEM-24, SHV-4, SHV-5) ou équivalente pour ces deux molécules (ex : TEM-3, SHV-2). Exemples : SHV-2 dérivée d’une pénicillinase de type SHV-1 / TEM-3 dérivée d’une pénicillinase de type TEM / CTX-M (non dérivées des pénicillinases TEM et SHV) qui hydrolyse plus efficacement le CTX > CAZ. |
| ⚡ Pénicillinases résistantes aux inhibiteurs TRI (groupe fonctionnel 2br) |
| ↦ Elles sont, pour la plupart, dérivées par mutation ponctuelle des pénicillinases TEM-1 et TEM-2. ↦ Leur activité hydrolytique sur les céphalosporines est amoindrie par rapport à TEM-1 ou TEM-2. |
| ⚡ Carbénicillininases (groupe fonctionnel 2c) |
| ↦ Leur activité hydrolytique est plus importante sur les carboxypénicillines que sur la benzylpénicilline. |
| ⚡ Céfuroximases (groupe fonctionnel 2e) |
| ↦ Actives sur les aminopénicillines (à moindre niveau sur les uréîdo- et les carboxypénicillines),
les C1G, les C2G (sauf les céphamycines). ↦ Sensibles au clavulanate. |
| ⚡ Carbapénémases (groupe fonctionnel 2f) |
| ↦ onférent une résistance à presque toutes les β-lactamines, y compris les C3G, les C4G et les
carbapénèmes et sont inhibées de manière variable par les IBL ↦ Selon le support génétique, on distingue : ❑ Carbapénémases de classe A plasmidiques : Elles peuvent conférer une résistance à l’ensemble des β-lactamines, y compris les céphamycines, les C3G, les C4G et les carbapénèmes. ❑ Carbapénémases de classe A chromosomiques inductibles (Rares) : Responsables d’une sensibilité diminuée ou d’une résistance aux pénicillines, aux C1G, aux C3G et à l’IPM. Les C4G restent actives. |
◍ Les enzymes de classe B (groupe fonctionnel 3) |
|---|
|
↦ Ce sont des carbapénémases aussi appelées métallo-β- lactamases (=MBL) en raison de leur
cofacteur : l’ion Zn
2+.
↦ Elles hydrolysent plus ou moins toutes les β -lactamines y compris les carbapénèmes, à l’exception de l’aztréonam. ↦ Elles ne sont pas inhibées par les IBL comme l’acide clavulanique, mais inhibées par les chélateurs d’ions comme l’EDTA. ↦ Parmi elles, on peut citer les carbapénémases codées par les gènes plasmidiques: - NDM-1 (New Delhi metallo-β-lactamase 1), - (IMP)-type carbapenemases (Imipenem-resistant Pseudomonas), - VIM (Verona integron-encoded metallo-β-lactamase), - GIM (German imipenemase), - SIM (Seoul imipenemase). |
◍ Les enzymes de classe C (groupe fonctionnel 1) |
|---|
|
↦ Ce sont des céphalosporinases de type AmpC.
↦ Leur spectre d’activité comprend les aminopénicillines, les C1G et selon la nature de l’enzyme les C2G dont les céphamycines. Elles hydrolysent dans une moindre mesure les carboxypénicillines, les uréîdopénicillines et les C3G (Les enzymes hyperproduites pourront inactiver efficacement ces substrats). ↦ Elles ne confèrent généralement pas de résistance aux carbapénèmes et aux C4G (sauf AmpC mutantes dites à spectre étendu). ↦ Ces enzymes sont résistantes aux β-lactamines inhibitrices mais pas à la cloxacilline. |
◍ Les enzymes de classe D : « oxacillinases » (= OXA-β-lactamases), (groupe fonctionnel 2d). |
|---|
|
↦ Elles hydrolysent très fortement les pénicillines M
↦ Elles sont caractérisées par leur résistance au clavulanate (néanmoins OXA-18 par exemple est très sensible à l’acide clavulanique) ↦ Elles possèdent une légère activité vis-à-vis des céphalosporines à spectre étroit. ↦ Certaines ont une faible activité hydrolytique sur les carbapénèmes : CHDLs = « Carbapenems Hydrolysing class D β-lactamases » ⚡ OXA-48 n’est pas une carbapénémase puissante ; en l’absence d’autres mécanismes de résistance comme d’autres β-lactamases (type BLSE ou AmpC), de perte de porines ou de pompes à efflux, elle entraîne une légère diminution de la sensibilité aux carbapénèmes (résistance à bas niveau), ce qui peut rendre sa détection au laboratoire difficile. ↦ Elles sont inhibées de manière variable par le NaCl. ↦ Les gènes codant ces enzymes se trouvent le plus fréquemment dans des intégrons de classe 1, mais il a été montré que des structures incluant des séquences d’insertion et des transposons pouvaient être également le support génétique de certains gènes codant ces enzymes (Ex : gène blaOXA-48). |
Ⅵ.1: Entérobactéries : Résistances naturelles
❑ Groupe 0
- Les entérobactéries ne possédant aucun gène codant pour une β-lactamase: le genre Salmonella et l’espèce Proteus mirabilis.
- Naturellement sensibles à toutes les β-lactamines testées
⛔ Les diamètres d'inhibition de l'imipénème sont souvent réduits pour l'espèce P.mirabilis (faible affinité pour PLP2) , cette diminution est sans conséquences cliniques, contrairement à la résistance acquise par mutation de la PLP2
❑ Groupe 1
- Céphalosporinase constitutive de très bas niveau (gène ampC) non inductible: E. coli et le genre Shigella
- Selon le niveau d’expression:
- Une sensibilité à toutes les βlactamines testées
- Une réduction de la sensibilité à AMP (S/I) , à AMC (S/I) et/ou au C1G (S/I).
❑ Groupe 2
- Une pénicillinase chromosomique constitutive exprimée à bas niveau: genres Klebsiella, Raoultella, Citrobacter koseri, E. hermanii
- Résistance aux aminopénicillines (AMP = R) et aux carboxypénicillines (TIC = R).
⛔ Elles apparaissent généralement sensibles in vitro aux uréidopénicillines, qu’il convient de corriger en intermédiaires, conformément aux règles de lecture interprétative ( PIP : S ↦ I ) .
⛔ Le phenotype ❞pénicillinase de bas niveau❞ se caractérise par la persistance d'un diamètre d’inhibition autour des disques d'aminopénicilline , contrairement au phenotype ❞pénicillinase de haut niveau❞(pas de diamètre d’inhibition autour des disques AMP)
❑ Groupe 3
- Céphalosporinase AmpC, résistante aux inhibiteurs et inductible par les β-lactamines: Enterobacter cloacae, E. aerogenes, E. asburiae, Serratia marcescens, C. freundii, C. braakii, C. youngae, Morganella morganii, Providencia rettgeri, P. stuartii, Hafnia alvei et Pantoea agglomerans.
- Résistance aux AMP (R), à AMC (R) et aux C1G (R). Selon les espèces, il peut s’ajouter une résistance ou une sensibilité intermédiaire à la FOX (S/I/R) et au CXM (S/I/R)
FOX > CXM
Enterobacter et C. freundii (et apparentées)
FOX < CXM
S. marcescens et Morganella morganii
Sensibles
Hafnia alvei, Providencia et P. agglomerans
NB : des images d’antagonisme peuvent être observées sur l’antibiogramme en diffusion entre les disques de la plupart des β-lactamines hydrolysées (les pénicillines, les céphalosporines de 2e et 3e génération) et des disques contenant des β-lactamines induisant fortement la production de la céphalosporinase comme l’imipénème, la céfoxitine ou le clavulanate.
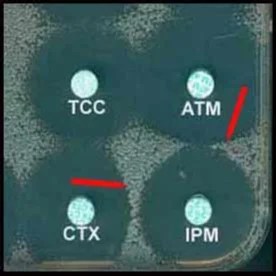
❑ Groupe 4
- Céphalosporinase inductible (classe C) + enzyme sensible aux inhibiteurs (classe A) : Yersinia enterocolitica et Serratia fonticola.
- Résistance aux AMP, aux TIC et aux C1G. S. fonticola est également souvent résistante au CXM. Enfin la résistance aux AMC est généralement présente chez Y. enterocolitica, et plus rarement chez S. fonticola
NB : La résistance aux uréidopénicillines n’est généralement pas observée in vitro et une correction en intermédiaire s’avère nécessaire ( PIP : S ↦ I ) .
❑ Groupe 5
- Céfuroximase inductible: P. vulgaris et P. penneri
- résistance aux AMP, aux C1G et au CXM, ainsi qu’une sensibilité aux AMC.
❑ Groupe 6
- Comprend d’une part des espèces environnementales (la plupart des espèces de Kluyvera ), rares en clinique humaine, qui produisent des BLSE de manière constitutive à bas niveau, et d’autre part des espèces de Citrobacter (C. amalonaticus, C. farmeri et C. sedlakii ) qui produisent une BLSE inductible.
Ⅵ.2: Entérobactéries : Résistances acquises
⚡ Pénicillinases acquises
Une résistance limitée aux amino et carboxypénicillines
⇥ Une interprétation des résultats des uréidopénicillines de sensible en intermédiaire

Figure: E.coli productrice de TEM (Exemple 1)
Une résistance à haut niveau à toutes les pénicillines associées ou non aux inhibiteurs de β-lactamases et aux céphalosporines de 1re génération, voire celles de 2e génération.

Figure: E.coli productrice de TEM (Exemple 2)
⚡ Pénicillinase résistante aux inhibiteurs
Une résistance aux amino et carboxypénicillines seules ou en association avec les inhibiteurs. La résistance aux uréïdopénicillines est plus faible voire absente et l’association pipéracilline-tazobactam, bien que plus bactéricide, est généralement bactériostatique.
⇥ La correction des résultats sensibles des uréïdopénicillines en intermédiaires est nécessaire.

Figure: E.coli productrice de TRI
⚡ β-lactamase à spectre étendu
Une résistance à toutes les pénicillines, aux céphalosporines de 1re et 2e génération et à au moins une céphalosporine de 3/4e génération (C3/4G) ou à l’aztréonam.
La sensibilité aux associations pénicillines-inhibiteurs de β-lactamases est souvent conservée. L’association TZP est l’association pénicilline-inhibiteur la plus souvent active.
◍ Détection des β-lactamases

Figure: E.coli productrice d’une BLSE
⚡ Céphalosporinase de haut niveau
Une résistance est observée à toutes les pénicillines seules ou en association avec des inhibiteurs ainsi qu’à toutes les céphalosporines de 2e génération (C2G) et aux céphamycines (sauf H. alvei).
L’hyperproduction d’une céphalosporinase confère une résistance à au moins une C3G. Les C4G ne sont généralement pas touchées.
Le test de synergie est négatif entre les C3G, les C4G ou l’ATM et les β-lactamines inhibitrices.
⇥ Si les isolats cliniques producteurs de BLSE associée à une hyperproduction de céphalosporinase, la détection de l’image de synergie peut être facilitée par le rapprochement des disques de céphalosporine de celui du disque contenant de l’acide clavulanique ou en pratiquant un antibiogramme standard sur gélose Mueller-Hinton additionnée de 250 mg/L de cloxacilline.
⇥ Si une entérobactérie est résistante à au moins une C3G et que le test de synergie est négatif, les C3G ne doivent pas être rendues sensibles.
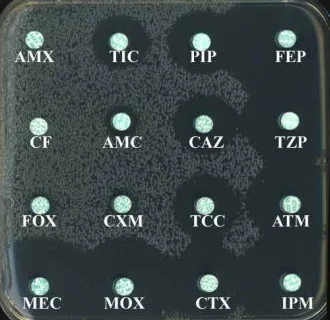
Figure: E.coli productrice d’une Case type CMY
⚡ Carbapénamases
La résistance aux carbapénèmes chez les entérobactéries peut être liée à deux mécanismes:
- La production à haut niveau d’une Case chromosomique ou plasmidique, associée à une modification de la perméabilité.
- La production de carbapénèmases

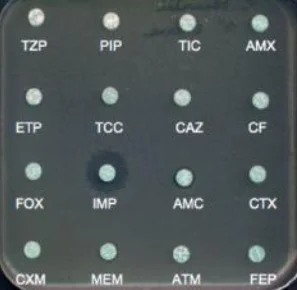
La plupart des carbapénémases hydrolysent les céphalosporines et les carbapénèmes. C’est le cas des carbapénémases de type KPC et des métallo-β-lactamases (MBL) . Les carbapénémases de type OXA-48 n’hydrolysent pas ou très peu les céphalosporines de 3e /4e générations. Cependant, plus de 80% des souches exprimant OXA-48 co-expriment une BLSE (CTX-M) leur conférant une résistance associée aux céphalosporines de 3e et 4e générations
◍ Détection des Carbapénamases