Contenu :
Gélose XLD | Principe | Préparation | Interpretation
Ⅰ. Généralités
La Gélose XLD (Gélose xylose-lysine-désoxycholate) est un milieu différentiel modérément sélectif servant à l'isolement et à la différenciation des agents pathogènes entériques Gram négatifs en particulier les salmonelles et les shigelles dans les échantillons cliniques, environnementaux ou provenant des aliments.
Il repose sur la fermentation du xylose, du lactose et du saccharose, la décarboxylation de la lysine et la production d'hydrogène sulfuré pour la différenciation primaire des shigelles et des salmonelles.
La gélose XLD, initialement formulé par Taylor W.I. 1965, est l’un des milieux recommandés dans la Pharmacopée américaine (USP) et européenne (EP) pour le dénombrement des microorganismes.
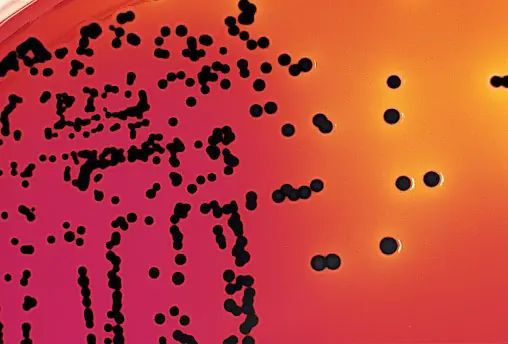
Colonies de Salmonella H2S-positives sur gélose XLD. (1)
Ⅱ. Préparation / Composition
Milieu XLD déshydraté
Suspendre les composants, poudre déshydratée, dans l'eau (53 grammes dans 1000 ml d'eau purifiée/distillée),Chauffer, en agitant fréquemment, jusqu'à ce que le milieu commence à bouillir (NE PAS SURCHAUFFER et NE PAS AUTOCLAVER).
Transférer immédiatement au bain-marie tempéré à environ 50°, continuer d'agiter jusqu'à refroidissement du milieu à environ 50° et verser dans des boîtes de Pétri stériles.
Milieu XLD préparé
Faire fondre le contenu du flacon au bain-marie à 100°C (en desserrant le bouchon partiellement retiré) jusqu'à dissolution complète. Refroidir immédiatement à 45-50°C, bien mélanger en évitant la formation de mousse et répartir aseptiquement dans des boîtes de Pétri.
Composition gélose XLD |
|||
|---|---|---|---|
| Ingrédients | gramme/litre | Ingrédients | gramme/litre |
| Extrait de levure | 3gr | Chlorure de sodium | 5g |
| L-lysine HCl | 5g | Thiosulfate de sodium | 6.8g |
| Xylose | 3.75g | Citrate d'ammonium ferrique | 0.8 g |
| Lactose | 7.5g | Rouge de phénol | 0,08g |
| Saccharose | 7.5 g | Gélose | 12.5 |
| Désoxycholate de sodium | 1,0 g | pH | 7,4 ± 0,2 @ 25°C |

Gélose XLD deshydraté
Ⅲ. Principe et interpretation
La gélose xylose lysine désoxycholate (XLD) est un milieu sélectif, différentiel et indicateur. Les trois sources de glucides ajoutées sont présentes à des concentrations différentes, le xylose est limité tandis que le lactose et le saccharose sont considérés comme inépuisables pendant la période d'incubation prescrite.
◈ La sélectivité : L'agent sélectif est le désoxycholate de sodium, un sel biliaire, qui inhibe la croissance des organismes à Gram positif.
◈ La différenciation : Se fait par trois systèmes indicateurs
- Le xylose, le lactose et le saccharose, associés au rouge de phénol, sont les glucides fermentescibles. La fermentation des sucres ramène le pH du milieu à un état acide et la couleur du milieu vire vers le jaune
- La décarboxylation de la lysine, en l'absence de fermentation lactose et saccharose, entraîne un retour à un pH alcalin. Ce pH alcalin fait revenir la couleur rouge du milieu.
- Le thiosulfate de sodium et l'ammonium ferrique servent d'indicateurs de la production d'hydrogène sulfuré (H2S) dans des conditions alcalines
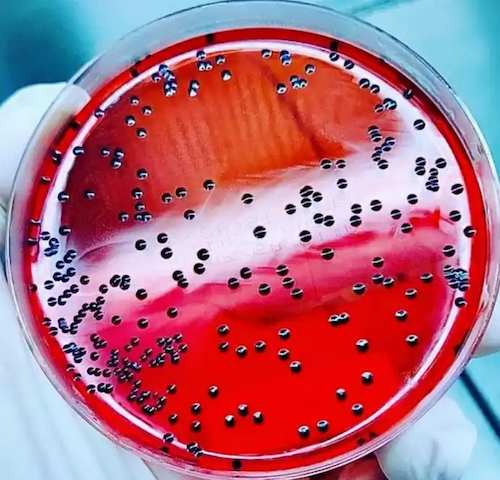
Les salmonelles peuvent être différenciées des membres du microbiote entérique normal par trois réactions : la fermentation du xylose, la décarboxylation de la lysine et la production de sulfure d'hydrogène. (@eumicrobiologia)
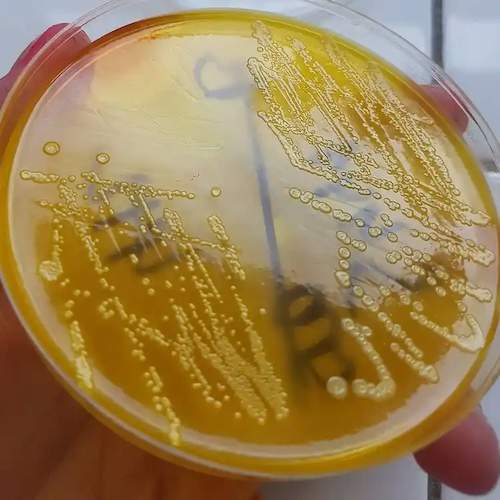
E.coli sur gélose XLD (@rado.kulich)
⚡ Les organismes incapables d'utiliser les glucides, tels que Shigella, Providencia et Edwardsiella, ne produira aucun changement significatif et donc les colonies et le milieu resteront rouges après l'incubation
⚡ Les organismes capables de fermenter uniquement le xylose, tels que Salmonella, épuiseront l'approvisionnement en xylose et commenceront à utiliser la lysine modifiant ainsi le pH en alcalin et un retour de la couleur au rouge. Cependant, la présence de Salmonella et Edwardsiella spp est différenciée de celle des shigelles par un indicateur de sulfure d'hydrogène.
⚡ D'autres organismes non inhibés, capables de fermenter le lactose ou le saccharose, produiront des colonies jaunes en raison de la production continue d'acide, le niveau élevé d'acide produit empêche de ramener le pH à une valeur alcaline, et d'un changement de pH qui en résulte. Ces organismes comprennent Escherichia, Klebsiella, Serratia, Citrobacter koseri, Yersinia enterocolitica, Providencia rettgeri et Morganella morganii.
⚡ Des colonies jaunes sont également observées pour les organismes lysine-négatifs, tels que les espèces Proteus.
⚡ L'inclusion d'un système indicateur d'H2S composé de thiosulfate de sodium et de citrate d'ammonium ferrique améliore la capacité de différenciation de la préparation : cela permet de visualiser la production de sulfure d'hydrogène, qui provoque la formation de colonies dont les centres sont de couleur noire.
| Organismes | Croissance | Résultats |
|---|---|---|
| Salmonella H2S positif, Edwardsiella | Bonne | Colonies rouges à centre noir |
| Shigella spp. et Salmonella H2S négative, Providencia | Bonne | Colonies rouges |
| E. coli | Inhibition partielle | Colonies jaunes |
| Enterobacter / Klebsiella | Inhibition partielle | Colonies jaunes / Colonies jaunes et mucoïdes |
| Proteus | Colonies rouges à jaunes, certaines souches de Proteus donneront des colonies à centre noir | |
| Pseudomonas | Inhibition partielle | Colonies rouges "Shigella-like" |
| Enterococcus | Inhibée | / |
| Bactéries Gram-positives | Inhibée | / |
Note:
⚡ Une incubation de plus de 48 heures peut conduire à des résultats faussement positifs. la couleur disparaît au bout de 24 heures, les observations doivent donc être effectuées entre 18 et 24 heures
⚡ Une incubation prolongée au-delà des délais recommandés n'est pas prescrite car des faux positifs peuvent survenir en raison de la réversion alcaline des colonies normalement acides
⚡ Certaines espèces de Shigella (1%) fermentent le lactose et produisent des colonies jaunes atypiques
⚡ S. Paratyphi A, S. Choleraesuis, S. Pullorum et S. Gallinarum peuvent former des colonies rouges sans H2S, ressemblant ainsi à Shigella