Contenu :
Virus de l'hépatite C : Transmission, Symptômes, Diagnostic, Traitement et Prévention
✑ Dr.Hamzaoui.f
Ⅰ.Hépatite C: Classification/ Structure
- Le virus de l’hépatite C (VHC) est un virus hépatotrope. Il appartient à la famille des Flavivirdae et au genre des Hepacivirus. Les souches de VHC se répartissent en 7 génotypes (1 à 7)
Le VHC circule dans le sang sous la forme de lipoviroparticules (LVP) : les particules infectieuses sont associées à des apolipoprotéines, telles que l’apoA-1, l’apoB-48, l’apoB-100, l’apoC-1 et l’apoE et à du Cholestérol
Il s’agit d’un virus enveloppé. L’enveloppe est le lieu d’ancrage des glycoprotéines E1 et E2.
La capside virale icosaédrique est formée de l’assemblage de nombreuses copies de la protéine de capside.
Le génome est formé d’une molécule d’ARN de polarité positive. L’ARN génomique sert d’ARN messager et possède donc la capacité d’être directement traduit dans le cytoplasme des hépatocytes infectés. Il sert également de matrice pour la formation du brin complémentaire de polarité négative lors de la réplication du génome viral.
L’ARN comporte un seul cadre de lecture ouvert, flanqué à ses 2 extrémités par des séquences non codantes (NC) de longueurs variables. Cet ORF code une polyprotéine précurseur qui donnera naissance aux protéines virales structurales (C, E1 et E2) et non structurales (p7, NS2, NS3-4A, NS4B,NS5A et NS5B).
Légende : Les losanges indiquent les clivages réalisés par les protéases cellulaires (signalase et peptide peptidase). Les flèches indiquent les clivages réalisés par les protéases virales (NS2/NS3 et NS3/4A). Les points verts indiquent les sites de glycosylation des 2 glycoprotéines E1 et E2
Les régions 5’NC et 3’NC jouent un rôle majeur dans la réplication du génome viral. La région 5’NC est impliquée dans l’initiation de la traduction selon un mécanisme indépendant de la coiffe grâce à l’IRES (site d’entrée interne du ribosome : domaines II, III et IV).
Viabilité et résistance physico-chimique du VHC
- Le VHC est résistant aux Ultra-Violets.
- Il est relativement instable dans le plasma, cependant, il peut survivre au séchage et à l’exposition à une température ambiante pendant au moins 16 h.
- Sensibilité aux désinfectants : les données sur la sensibilité du VHC aux désinfectants sont limitées. Etant donné que le VHC est un virus enveloppé, les mesures générales d'inactivation contre le virus de l'hépatite B peuvent s'appliquer au VHC : hypochlorite de sodium 1 %, éthanol 70 %, glutaraldéhyde à 2 %, formaldéhyde.
Ⅱ.Hépatite C :Cycle de multiplication
☰ Le cycle de multiplication du VHC se déroule exclusivement dans le cytoplasme des hépatocytes.
• L’attachement Grâce à l’interaction avec de nombreuses molécules exprimées à la surface des hépatocytes [glycosylaminoglycanes, récepteur aux LDL, CD81, SR-B1 (scavenger receptor B1), claudin-1, occludine, le récepteur au facteur de croissance épidermique (EGFR) et le récepteur à l’éphrine A2 EphA2)].
• La pénétration est dépendante du pH, ce qui suggère qu’elle a lieu par endocytose.
• La nucléocapside est libérée dans le cytoplasme, ce qui permet secondairement la libération de l’ARN viral (ARN génomique).
• La traduction de L’ARN viral par les ribosomes cellulaires et la formation d’une polyprotéine précurseur qui est est clivée de manière co- et post-traductionnelle par l’action de protéases cellulaires (signalase et signal peptide peptidase) et virales (NS2/NS3 et NS3/4A).
• Synthèse d’ARN simple brin de polarité négative, de séquence complémentaire à l’ARN génomique. Ce brin de polarité négative sert de matrice pour la synthèse de nombreuses molécules d’ARN viral génomique de polarité positive.
• Les brins d’ARN de polarité positive nouvellement synthétisés vont servir de matrices pour la traduction et la réplication du génome ou seront encapsidés pour former de nouvelles particules virales.
• Les nucléocapsides acquièrent l’enveloppe par bourgeonnement à travers la lumière du RE et sont sécrétées à l’extérieur de la cellule par l’appareil de Golgi.
Ⅲ.Hépatite C:Modes de transmission et épidémiologie
Le réservoir du VHC est strictement humain. Le virus est retrouvé principalement dans le sang. Cependant, l'ARN du VHC a été retrouvé en faible quantité dans d'autres liquides biologiques : salive, liquide d'ascite, sperme, LCR
VHC: Modes de transmission
☰ Le virus de l’hépatite C est transmis par le sang. Cette transmission s’opère le plus souvent par :
☛ La consommation de drogues injectables avec partage du matériel d’injection ;
☛ La réutilisation ou la stérilisation incomplète du matériel médical, en particulier des seringues et des aiguilles, en milieu de soins ;
☛ La transfusion de sang et de produits sanguins n’ayant pas fait l’objet d’un dépistage ;
☛ Les pratiques sexuelles entraînant une exposition à du sang.
☰ Autres modes de transmission :
☛ La transmission sexuelle : Elle est possible mais très faible de 0 à 5%
☛ La transmission verticale mère-enfant : Le risque de transmission du VHC à l’enfant est estimé entre 3 à 5%, et il est beaucoup plus élevé en cas de coïnfection par le virus du SIDA (VIH) où il atteint 25% (Ce risque est corrélé au niveau de la charge virale de la mère et au génotype, la transmission a lieu au moment de l’accouchement).
☛ La Transmission intra familiale : elle est très rare, et pourrait être favorisée par une forte promiscuité et des conditions d’hygiène défectueuses.
VHC: Epidémiologie
À l’échelle mondiale, on estime que 71 millions d’individus sont porteurs chroniques de l’hépatite C. L’OMS estime, qu’en 2015, il y avait 1,75 million de nouvelles infections par le VHC dans le monde et qu’en 2016, environ 399 000 personnes sont mortes d’une hépatite C, le plus souvent des suites d’une cirrhose ou d’un carcinome hépatocellulaire (cancer primaire du foie).
L’VHC sévit à l’état endémo-épidémique sans influence saisonnière.
☰ Au niveau mondial :
Le taux de prévalence varie de 0,5 à 5% selon les pays et même selon les régions d’un même pays. On distingue 3 zones de prévalence :
☛ Zone de faible endémicité : séroprévalence de 0,5% dans les pays Scandinaves, Australie, Canada, et la Suisse.
☛ Zone d’endémicité moyenne : 1% de séroprévalence en Europe de l’Ouest et les Etats Unis d’Amérique
☛ Zone de forte endémicité : séroprévalence de l’ordre de 2 à 6% dans le reste des pays du monde (Europe de l’est, Asie, Afrique, Amérique du Sud).
☰ En Algérie:
Selon l’OMS, l’Algérie est un pays de moyenne endémicité pour le VHC avec incidence de 3,1 pour 100000 habitants indiquée par les chiffres officiels (2015).
Ⅳ.Hépatite C : Variabilité génétique
☰ La variabilité du VHC s’explique par :
☛ Des niveaux élevés de production et de clairance virales quotidiennes, de l’ordre de 10 virions en moyenne
☛ Des populations virales de taille considérable,
☛ Une polymérase susceptible de générer des erreurs au cours de la réplication car elle est dépourvue d’activité 3’-5’ exonucléase correctrice (activité de proofreading) : il y a donc environ une erreur par copie du génome qu’elle ne peut corriger.
Les substitutions nucléotidiques s’accumulent donc sur le génome au cours des cycles de réplication successifs.
1- Génotypes et sous types :
Les souches de VHC se répartissent en 7 génotypes (1 à 7). Au sein de chaque génotype, il existe un nombre varié de sous-types.
Les génotypes 1, 2 et 3 sont largement distribués, tandis que les génotypes 4, 5 et 6 sont généralement confinés à certaines régions.
| Génotype 1 | Le plus largement distribué et représente le génotype le plus fréquemment isolé en Amérique du Nord, en Europe, en Amérique du Sud, en Asie et en Australie. |
|---|---|
| Génotype 3 | Représente près de la moitié des souches isolées au Royaume-Uni et au Danemark et est le génotype majoritaire en Inde, au Pakistan et en Thaïlande. |
| Génotype 4 | Circule majoritairement en Egypte. |
| Génotype 5 | Quasi exclusivement retrouvé en Afrique du Sud. |
| Génotype 6 | Endémique en Asie du Sud-Est et est fréquemment isolé à Hong Kong et en Chine. |
Le génotype viral pourrait influencer le taux de passage à la chronicité de l’infection aiguë. Par opposition, le génotype ne semble pas influencer la présentation clinique et la sévérité des lésions hépatiques ou le développement de manifestations extra-hépatiques.
La détermination du génotype voire du sous-type (1a versus 1b) pour les patients infectés par un génotype 1 est essentielle pour la prise en charge du malade car elle conditionne jusqu’à présent le traitement antiviral et sa durée pour certaines combinaisons thérapeutiques.
2- Distribution en quasi-espèces:
Le VHC circule donc chez tout malade infecté sous la forme d’un mélange complexe en équilibre instable de variants viraux génétiquement distincts bien qu’apparentés et soumis à l’influence des pressions de sélection exercées par l’environnement réplicatif.
La distribution en quasi-espèces du VHC est un des mécanismes par lequel le virus est capable d’échapper à la pression de sélection liée aux réponses cellulaires et humorales de l’hôte. La distribution en quasi-espèces du VHC joue également un rôle majeur dans l’échec aux traitements en sélectionnant de façon graduelle des variants viraux résistants.
Ⅴ. Histoire naturelle de l’infection par le VHC
☰ La phase d’incubation dure en moyenne 4 à 12 semaines puis survient la phase aigüe de l’infection.
1- Hépatite C aigue :
L’hépatite aigue est le plus souvent asymptomatique ou pauci-symptomatique (nausée, perte d’appétit, fatigue, douleurs abdominales), avec une augmentation de l’activité sérique de l’ALAT qui peut être supérieure à 1 000 U/L.
15 à 20% des patients environ éliminent spontanément le virus. Cette guérison spontanée se définie par la disparition de l’ARN-VHC dans le sérum qui devra être contrôlée conventionnellement à 2 reprises à 6 mois d’intervalle.
- Les transaminases se normalisent rapidement
- Les anticorps anti-VHC persistent dans le sang.
- Dans 80 à 85% des cas, on observe un passage à la chronicité.
2- Hépatite C chronique :
La persistance de l’ARN viral dans le sérum pendant plus de 6 mois après le début de l’infection traduit le passage à la chronicité.
L’hépatite chronique est associée à des degrés divers à une activité nécroti-inflammatoire et à une fibrose hépatique. Les principaux facteurs favorisant la fibrose sont :
☛ Le sexe masculin,
☛ L’âge,
☛ La consommation excessive d’alcool,
☛ L’existence d’un syndrome métabolique
☛ À un moindre degré la coïnfection par le VIH ou le VHB.
L’hépatite chronique peut évoluer sous différentes formes :
• Une hépatite chronique à transaminases normales 10 à 50% des cas.
Définie par une activité sérique de l’ALAT normale sur 3 prélèvements distincts effectués durant
une
période de 6 mois. Ceci est lies à une faible réponse immunitaire de l’hôte vis-à-vis de
l’infection virale.
• Une hépatite chronique minime 10 à 40% des cas.
Elle est asymptomatique (+++).
Les transaminases sont modérément élevées.
Sur le plan histologique, elle est définie par un infiltrat inflammatoire exclusivement situé
dans l’espace
porte sans envahissement de la lame bordante et sans fibrose. Le score Métavir de fibrose est
situé
entre F0 et F1 et celui de l’activité entre A0 et A1.
• Une hépatite chronique modérée ou sévère 50 à 80% des cas.
Elle est la plupart du temps asymptomatique.
Le bilan hépatique met en évidence une élévation de l’ALAT.
Ce groupe se définit par le résultat de la biopsie hépatique avec le score Métavir qui varie
entre F2 et
F4 et entre A2 et A3.
L’évolution de la maladie hépatique jusqu’au stade de cirrhose ou de CHC est généralement lente (20 à 30 ans en moyenne) en l’absence de facteurs de comorbidité (les individus co-infectés par le VIH, contaminés après l’âge de 40 ans, ou ayant une consommation excessive d’alcool).
De nombreuses manifestations extra-hépatiques ont été rapportées au cours de l’hépatite chronique C. Parmi les plus fréquentes, on note la vascularite liée à une cryoglubulinémie, responsable d’atteintes cutanées, rénales, rhumatologiques ou neurologiques.
Ⅵ. Outils du diagnostic virologique de l'hépatite C
☰ Les outils virologiques du virus C sont de 2 types :
• Les marqueurs virologiques directes : antigènes viraux ou ARN viral.
• Les marqueurs indirects : les anticorps dirigés contre les protéines virales.
1- Détection des anticorps anti VHC
☰ Tests immuno-enzymatiques : test ELISA
La fenêtre sérologique entre le contage et la séroconversion est en moyenne de 70 jours avec les tests immuno-enzymatiques de 3ème génération
Les tests commerciaux actuellement disponibles détectent des IgG dirigés contre des protéines structurales (protéine de capside) et non structurales du virus (protéines NS3, NS4, et NS5). Ces tests sont à la fois très spécifiques (≥99%) et très sensibles (100%)
☰ Faux négatif :
- A la phase aigüe de la maladie précédant la séroconversion.
- Chez des patients hémodialysés ou profondément immunodéprimés comme les transplantés d’organes ou de moelle.
- Chez certains sujets infectés par le VIH.
- Chez les hypo- ou agammaglobulinémiques.
Le test de Combo est un test permettant la détection simultanée de l’antigène de la capside du VHC et des anticorps anti-VHC. Cette détection simultanée permet de réduire la fenêtre sérologique d’une trentaine de jours.
Ce test est peu utilisé car il ne présente aucun intérêt clinique, il semblerait néanmoins utile chez les personnes immunodéprimées chez qui du fait de l’immunodépression les anticorps anti-VHC peuvent être absents.
☰ Tests rapides d’orientation diagnostic (TROD)
La technique la plus utilisée est l’immuno-chromatographie sur bandelettes
Prélèvements :
- Plasma et sérum
- Le sang total capillaire prélevé au bout du doigt avec des volumes faibles de sang collecté (10100 μL).
- Le liquide craviculaire (liquide sécrété entre le sillon antérieur de la gencive et les lèvres). Il contient des antigènes viraux ou des Ig antivirus en quantité plus faible que le sérum ou le plasma (3 à 5 fois selon la classe d’Ig).
Ces tests ont une moindre sensibilité par rapport aux méthodes EIA et une bonne spécificité mais tout résultat positif doit être contrôlé par une méthode de référence.
2- Détection et quantification de l’antigène de capside (AgC)
L’AgC est un marqueur indirect de la réplication virale fortement corrélé à la charge virale. Il est habituellement détectable 1 à 2 jours après l’ARN du VHC ensuite les cinétiques des deux marqueurs sont similaires.
La détection de l’AgC peut être utilisée pour :
☛ Réduire la période de la fenêtre sérologique dans le cadre du don de sang.
☛ Identifier les sujets réplicants si un test moléculaire n’est pas disponible.
La quantification de l’Ag C a été proposée par les sociétés savantes internationales pour le suivi de patients sous traitement antiviral.
3- Détection et quantification de l’ARN du VHC :
La détection et la quantification de l’ARN du VHC sont indispensables afin de :
- Poser le diagnostic d’hépatite C
- Identifier les patients qui ont une indication de traitement.
- Evaluer la réponse aux traitements antiviraux
- Détecter l’émergence de variants viraux résistants avec les antiviraux directs (DAAs).
La détection et quantification du génome se font par PCR (polymerase chain reaction) ou TMA (transcription-mediated amplification).
Les résultats doivent être exprimés en unités internationales par millilitre (UI/mL), idéalement en Log UI/mL, afin de pouvoir comparer les résultats émanant de différents laboratoires et utilisant des techniques différentes.
4- Détermination du génotype du VHC
La méthode de référence pour la détermination du génotype viral est l’analyse phylogénique de la séquence nucléotidique obtenue par séquençage direct (“population sequencing“) d’une portion du génome viral : Les séquences obtenues sont comparées avec les séquences de souches prototypes des bases de données, ce qui permet d’identifier de nouveaux génotypes ou des souches recombinantes entre des virus de génotypes différents.
D’autres méthodes existent :
- Les méthodes fondées sur l’hybridation inverse (plus rapides et plus sensibles que les méthodes de séquençage direct)
- Les méthodes de PCR en temps réel utilisant des amorces et des sondes spécifiques des génotypes.
☰ Détermination du profil de résistance génotypique
La méthode de référence pour l’identification des mutations de résistance est le séquençage du gène codant la protéine ciblée par l’agent antiviral.
La comparaison de la séquence préthérapeutique avec celle obtenue au moment de la suspicion de résistance doit être réalisée pour mettre en évidence le changement amino acidique.
Indication :La détermination du profil de résistance avant retraitement chez des patients en échec d’un ou plusieurs traitements antérieurs.
Ⅶ. Interprétation des résultats
En cas d’infection par le VHC, les marqueurs de l’infection recherchés sont les anticorps anti-VHC et l’ARN viral.
☰ Les situations à envisager :
• Si aucun des deux marqueurs n’est présent, le diagnostic d’une hépatite C aigue est improbable.
• Si les anticorps du VHC sont présents, il est recommandé que le résultat soit confirmé sur un second prélèvement en utilisant une technique différente. La recherche de l’ARN du VHC (ou de l’antigène de capside) doit être également réalisée sur le second prélèvement par une méthode sensible ayant un seuil de détection ≤15 UI/mL.
• La présence simultanée d’anticorps anti-VHC et de l’ARN viral (ou de l’antigène de capside) permet d’affirmer la présence du virus, sans distinguer l’infection aiguë de l’infection chronique.
• Si les anticorps anti-VHC sont absents mais l’ARN du VHC (ou l’antigène de capside) est présent, le diagnostic d’hépatite aiguë C est certain en l’absence d’immunodépression et sera confirmé par l’apparition des anticorps anti-VHC (séroconversion VHC) sur un prélèvement réalisé quelques semaines plus tard.
• Si les anticorps du VHC sont présents et que l’ARN viral est absent, il faudra une recherche ultérieure de l’ARN viral, car il peut être indétectable de façon transitoire au cours de l’évolution d’une hépatite aigue et réapparaitre plus tard lorsque l’infection devient chronique.
• Si seuls les anticorps anti-VHC sont présents, il n’est habituellement pas possible de différencier une hépatite C ancienne guérie d’un faux positif du test immuno-enzymatique.
Ⅷ. Traitements antiviraux
1- L’interféron α
Dans l’hépatite chronique C, les plus utilisés sont les IFN de sous type α-2a et α-2b.
l’IFN a essentiellement quatre fonctions :
☛ Diminution de la réplication virale : apparaît dans les 6 à 8 heures qui suivent l’injection d’interféron.
☛ Induction d’un état antiviral dans les cellules non infectées : prévient leur infection et donc la diffusion de l’infection
☛ Augmentation de la lyse des cellules infectées : suite à une augmentation de l’expression des complexes formés des peptides viraux et des molécules du CMH de la membrane cellulaire, et de la stimulation de l’activité des cellules NK et de l’activité LTc.
☛ Inhibition de la fibrogenèse hépatique.
Interféron pegylé
L’interféron pegylé est constitué d’un interféron standard conjugué avec un polyéthylène glycol. Ce processus de pegylation est utilisé afin de:
- Diminuer la clairance rénale → Augmentation de la demi-vie de l’interféron → Obtention d’une concentration plasmatique d’interféron plus stable et prolongée couvrant toute la semaine.
- Diminuer l’immunogénicité de la protéine.
2- Les analogues nucléosidiques : La ribavirine
La ribavirine est un analogue nucléosidique de la guanosine.
Le mécanisme d’action de la Ribavirine seule reste encore incertain, plusieurs hypothèses :
☛ Elle agit comme un inhibiteur de la polymérase virale affectant ainsi la synthèse des protéines virales.
☛ Elle augmente également la fréquence des mutations via son incorporation dans les génomes nouvellement synthétisés.
☛ Elle agit par des mécanismes immunomodulateurs, en favorisant la réponse T auxiliaire de type 1 (Th1) aux dépens de la réponse Th2, que par des effets directs antiviraux.
☛ Elle entraine une réduction du GTP via l’inhibition compétitive de l’inosine monophosphate déshydrogénase
L’association de la ribavirine à l’IFN augmente nettement l’efficacité du traitement
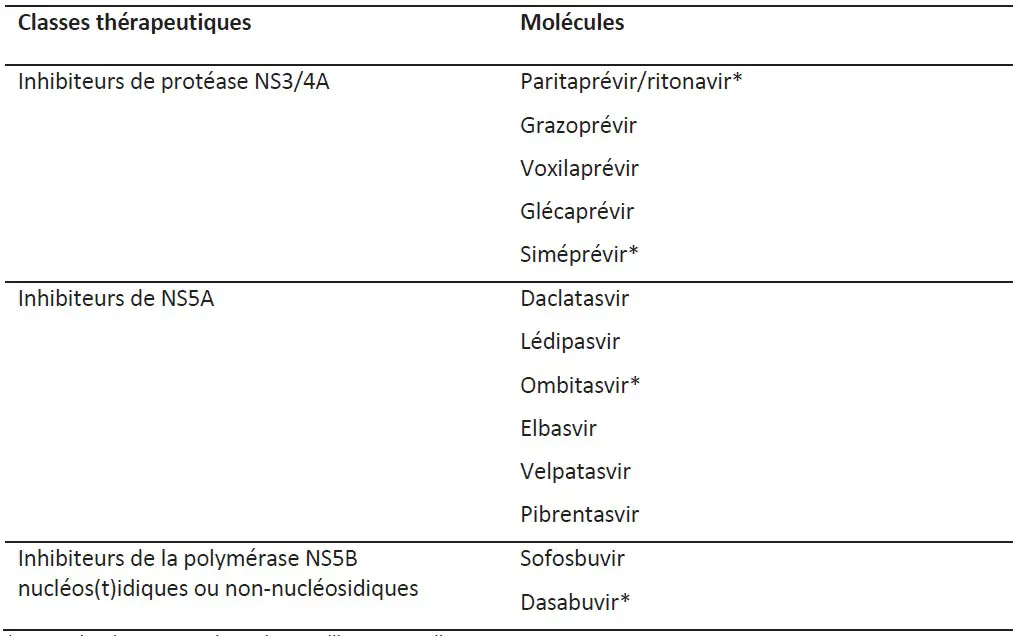
3- Antiviraux à action directe
• Inhibiteurs de la protéase NS3/4A : Les «------prévir»
La liaison de ses inhibiteurs au site catalytique de la protéase NS3/4A empêche de libérer des
protéines non structurales fonctionnelles.
• Inhibiteurs NS5A : Les «------asvir»
Les inhibiteurs NS5A agissent sur deux fronts : en bloquant la réplication et en inhibant
l’assemblage
des particules virales. Ils permettent ainsi une rapide décroissance de la réplication virale
dès les
premiers jours de traitement. La première génération inclut : daclatasvir, ombitasvir,
lédipasvir, etc.
• Inhibiteurs de la polymérase NS5B : Les «------buvir»
On distingue deux classes d’inhibiteurs de l’ARN-polymérase ARN-dépendante NS5B du VHC :
• Les analogues nucléos(t)idiques agissent après activation intracellulaire comme des substrats inhibiteurs, conduisant à un arrêt de la synthèse de la chaîne d’ARN viral. De par ce mécanisme d’action, ils présentent une activité pangénotypique et une barrière élevée aux résistances. Il s’agit d’analogues nucléosidiques (par exemple : méricitabine) ou nucléotidiques (par exemple : sofosbuvir)
• Les inhibiteurs non nucléosidiques se fixent sur l’un des quatre sites allostériques de la polymérase et modifient la conformation enzymatique (par exemple : dasabuvir, BMS-791325, etc.). En fonction du site ciblé, ils sont répartis en différents groupes. Cette première génération, active contre le génotype 1, présente une faible barrière aux résistances.
4- Agents ciblant l’hôte (HTA)
Ces molécules visent des cibles cellulaires de l’hôte susceptibles de contribuer à la réplication virale : cyclophiline (alisporivir) ou le micro-RNA 122 (miravirsen).
Ⅸ. Prophylaxie – Vaccination
Les activités de lutte contre l’hépatite virale devraient se concentrer sur la sensibilisation à la maladie et viser à empêcher qu’elle ne se répande davantage.
Il s’agit de promouvoir les pratiques sures d’injection, d’améliorer les techniques de désinfection et les rapports sexuels protégés. La rigueur dans le respect des règles d’hygiène et des procédures de décontamination devraient permettre de réduire voire éradiquer le risque de transmission.